
 2 K2S + K2SO3 + 3 H2O
2 K2S + K2SO3 + 3 H2O| A��a = 2b | B��x = 2 | C��n = 0.48 | D��b = 0.02 |
 2 K2S + K2SO3 + 3 H2O��Ӧ����0.08 mol�������뺬0.06 mol KOH������Һ��ַ�Ӧ����ʣ��0.05 mol������0.02mol K2S��0.01molK2SO3 ,ǡ������a mol K2Sx��b mol K2S2O3,�ɼ�Ԫ���غ㣺2a+2b=0.06,����Ԫ���غ㣺ax+2b=0.08���ټ�������KClO-KOH�Ļ����Һ����Ԫ��ȫ��ת��ΪK2SO4��ת�Ƶ���n mol���ɵ����غ㣺ax(6+2/x)+2b(6-2)=n�������൱��ʧ���ӵ�ȫ��0.08 mol��������n="0.08" mol*6=0.48mol������������ϵʽ��ã�x=3,a=0.02,b=0.01�ֱ��ѡ�������֤����֪AC���㡣
2 K2S + K2SO3 + 3 H2O��Ӧ����0.08 mol�������뺬0.06 mol KOH������Һ��ַ�Ӧ����ʣ��0.05 mol������0.02mol K2S��0.01molK2SO3 ,ǡ������a mol K2Sx��b mol K2S2O3,�ɼ�Ԫ���غ㣺2a+2b=0.06,����Ԫ���غ㣺ax+2b=0.08���ټ�������KClO-KOH�Ļ����Һ����Ԫ��ȫ��ת��ΪK2SO4��ת�Ƶ���n mol���ɵ����غ㣺ax(6+2/x)+2b(6-2)=n�������൱��ʧ���ӵ�ȫ��0.08 mol��������n="0.08" mol*6=0.48mol������������ϵʽ��ã�x=3,a=0.02,b=0.01�ֱ��ѡ�������֤����֪AC���㡣


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
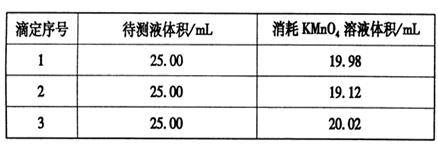
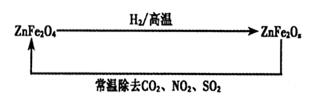
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��IClO | B��ICl3 | C��I2Cl6 | D��KIO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��S2�� | B��S | C��SO32�� | D��SO42�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Br2����������NaOH�ǻ�ԭ�� |
| B�����������뻹ԭ��������ʵ����ı�Ϊ5��1 |
| C��Br2�������������ǻ�ԭ�� |
| D��ÿ����1mol��NaBrO3ת��6mol�ĵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��1��1��ϵ�Pb3O4��PbO |
| B��1��2��ϵ�PbO2��Pb3O4 |
| C��1��4��1��ϵ�PbO2��Pb3O4��PbO |
| D��4��1��1��ϵ�PbO2��Pb3O4��PbO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��8.0mol��L-1 | B��9.0mol��L-1 | C��10.0mol��L-1 | D��11.0mol��L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��5/16 | B��5/17 | C��5/13 | D��13/5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A��ԭ�������NO3�������ʵ���Ϊ0.2 mol |
| B��ԭ�������H2SO4���ʵ���Ũ��Ϊ2mol/L |
| C��OA����BC�η�Ӧ�е���ת�Ƶ����ʵ���֮��Ϊ2:1 |
| D��ȡ20mLԭ������ˮϡ����1L����Һ��pH��1 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com