
某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
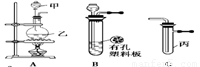
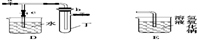
请按要求填空:
(1)利用B装置可制取的气体有 (填2种)。
A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。
若在丙中加入适量水,即可制得氯水。将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象结论如下:
|
实验序号 |
实验操作 |
现象 |
结论 |
|
Ⅰ |
将氯水滴入品红溶液 |
溶液褪色 |
氯气与水反应的产物有漂白性 |
|
Ⅱ |
氯水中加入 NaHCO3粉末 |
有无色气泡产生 |
氯气与水反应的产物具有较强的酸性 |
(2)请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由。
。
(3)请利用上述A、C装置设计一个简单的实验,验证Cl2和Br2的氧化性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)
。
B、D、E装置相连后,在B中盛装足量浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。
(4)B中发生反应的化学方程式为 。
(5)欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹 ,再打开止水夹 ,使烧杯中的水进入试管丁的操作是
。
(6)试管丁中的NO2与一定量的O2混合后倒插水中,试管9/10充满水,则原试管丁中的混合气体的平均分子量可能为 。(保留二位小数)
(1)H2、CO2、H2S等(1分)
(2)实验Ⅰ结论不合理,因为Cl2也有氧化性,此实验无法确定是Cl2还是HClO漂白(1分);实验Ⅱ结论不合理,因为制取的氯气中含有HCl气体,HCl溶于水后能与NaHCO3粉末反应产生气泡(1分)
(3)在甲、乙、丙中分别装入浓盐酸、MnO2、NaBr溶液,(1分)烧瓶中有黄绿色气体生成,试管中溶液由无色变为橙色,(1分) 证明Cl2的氧化性强于Br2,(1分)
(4)Cu+4HNO3(浓)→Cu(NO3)2+2NO2↑+2H2O (1分)
(5)a 、b (1分); c (1分) 双手紧握(或微热)试管丁使试管中气体逸出,NO2与水接触后即可引发烧杯中的水倒流入试管丁(1分)
(6)42.08(1分)或44.04(1分)
【解析】
试题分析:
(1)B装置适用于块状固体与液体的反应,可制取的气体有H2、CO2、H2S等。
(2)根据题意可知,实验Ⅰ结论不合理,因为Cl2也有氧化性,此实验无法确定是Cl2还是HClO漂白;实验Ⅱ结论不合理,因为制取的氯气中含有HCl气体,HCl溶于水后能与NaHCO3粉末反应产生气泡。
(3)在甲、乙、丙中分别装入浓盐酸、MnO2、NaBr溶液,烧瓶中有黄绿色气体生成,试管中溶液由无色变为橙色,Cl2可以氧化得到Br2,证明Cl2的氧化性强于Br2,
(4)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O (1分)
(5)结合题中实验目的可知答案。
(6)可设试管体积为10V,①若剩余气体为氧气1V,则反应的9V中二氧化氮的体积为9V×4/5,氧气的体积为9V×1/5,混合气体的平均分子量=46g/mol×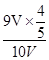 + 32g/mol×
+ 32g/mol×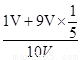 =42.08;②若剩余气体为一氧化氮1V,则原剩余二氧化氮的体积为3V, 则反应的7V中二氧化氮的体积为7V×4/5,氧气的体积为7V×1/5,混合气体的平均分子量=46g/mol×
=42.08;②若剩余气体为一氧化氮1V,则原剩余二氧化氮的体积为3V, 则反应的7V中二氧化氮的体积为7V×4/5,氧气的体积为7V×1/5,混合气体的平均分子量=46g/mol×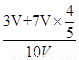 + 32g/mol×
+ 32g/mol× =44.04。
=44.04。
考点:考查元素及其化合物、电化学、化学实验、离子浓度判断等相关知识。


科目:高中化学 来源: 题型:阅读理解
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验 | 实验操作 | 现象 | 结论 |
| I | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯气与水反应的产物具有漂白性 |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应的产物具有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 实验 序号 |
实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气体产生 | 氯气与水反应的产物具有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 实验步骤 |
| ① | 将镁条用砂纸打磨后,放入沸水中,再向溶液中滴加酚酞溶液 |
| ② | 向新制得到的Na2S溶液中滴加新制的氯水 |
| ③ | 将一小块金属钠放入滴有酚酞溶液的冷水中 |
| ④ | 将镁条投入稀盐酸中 |
| ⑤ | 将铝条投入稀盐酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| ||
| ||
| 压强/Mpa 转化率 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com