
��10�֣���25�桢101kPa�����£���15L O2ͨ��10L CO��H2�Ļ�����У�ʹ����ȫȼ�գ�����ָ���ԭ�����¶Ⱥ�ѹǿ��
��1����ʣ������������15L����ԭCO��H2�Ļ�������У�V(CO)�� L��V(H2)�� L��
��2����ʣ����������Ϊa L����ԭCO��H2�Ļ�����У�V(CO)�� V(H2)�� ��
��3����ʣ����������Ϊa L����a��ȡֵ��Χ��α�ʾ��д�����ʵļ�����̡�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
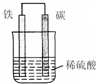
 ������أ�K2FeO4�����и�Ч���������ã�Ϊһ�����ͷ��ȸ�Ч����������ⷨ�Ʊ�������ز�����㣬�ɹ��ʸߣ�����ʵ�����Ʊ�����ԭ����ͼ��ʾ��
������أ�K2FeO4�����и�Ч���������ã�Ϊһ�����ͷ��ȸ�Ч����������ⷨ�Ʊ�������ز�����㣬�ɹ��ʸߣ�����ʵ�����Ʊ�����ԭ����ͼ��ʾ��| ��� | �ŵ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��ѧ�� | C-H | C-F | H-F | F-F |
| ���� | 414 | 489 | 565 | 158 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
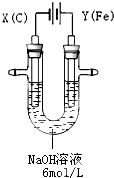
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��ɽ��ʡ�����и߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
X��Y��Z��W��Ԫ�����ڱ���ԭ������������������ֶ�����Ԫ�أ��������Ϣ���±���
|
Ԫ�� |
�����Ϣ |
|
X |
X������������Ӧ��ˮ���ﻯѧʽΪH2XO3 |
|
Y |
Y�ǵؿ��к�����ߵ�Ԫ�� |
|
Z |
Z�Ļ�̬ԭ�����������Ų�ʽΪ3s23p1 |
|
W |
W��һ�ֺ��ص�������Ϊ28��������Ϊ14 |
��1��Wλ��Ԫ�����ڱ��� ���ڵ� �壻W��ԭ�Ӱ뾶��X��
�����������
��2��Z�ĵ�һ�����ܱ�W�� �����С������ XY2�ɹ�̬��Ϊ��̬����˷��������������� ����Ԫ�ء�X��Y��ԭ�ӿɹ�ͬ�γɶ��ַ��ӣ�д������һ�����γ�ͬ�ַ��Ӽ�������������� ��
��3�����£���Z���������ᷴӦ�����ɫ��Һ�еμ�NaOH��Һֱ���������ܹ۲쵽�������� ��W�ĵ���������ᷴӦ����������ɫ���壬�÷�Ӧ�Ļ�ѧ����ʽ�� ��
��4����25�㡢101kpa�£���֪13.5g��Z���嵥����Y2��������ȫȼ�պ�ָ���ԭ״̬������419kJ���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
��5����ҵ��ұ��Zʱ�õ��Ĵ����DZ���ʯ����ȡ����ʯ(Na3AlF6)�Ļ�ѧ����ʽ���£� 2Al(OH)3+ 12HF+ 3 A = 2Na3AlF6+ 3CO2��+ 9H2O
�����������������գ�
�ٷ�Ӧ��A�Ļ�ѧʽΪ ������ ����
�ڱ���ʯ��Na3AlF6�������ӻ���������������ɣ�����ʯ�����ṹ����ͼ��ʾ�� λ�ڴ������嶥������ģ�
λ�ڴ������嶥������ģ� λ�ڴ��������12������е��8��С����������ģ���ô������������Ĵ���������������
�������������ţ�
λ�ڴ��������12������е��8��С����������ģ���ô������������Ĵ���������������
�������������ţ�

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com