
分析 依据热化学方程式和盖斯定律计算得到所需热化学方程式,根据盖斯定律Ⅱ-I×2得到.
解答 解:由反应I:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0 kJ•mol-1
反应II:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=-173.6kJ•mol-1
根据盖斯定律Ⅱ-I×2得:2CH3OH(g)=CH3CH2OH(g)+H2O(g)△H=-75.6 kJ•mol-1;
故答案为:2CH3OH(g)=CH3CH2OH(g)+H2O(g)△H=-75.6 kJ•mol-1.
点评 本题考查热化学方程式的书写以及盖斯定律的应用,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握计算的思路,难度不大.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:解答题


 ,
,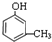
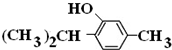 +3H2$→_{△}^{Ni}$
+3H2$→_{△}^{Ni}$
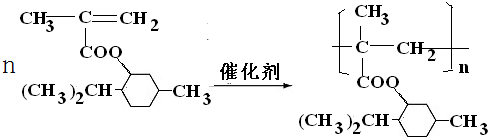 ;.
;.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | 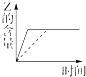 | C. | 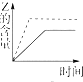 | D. | 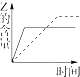 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

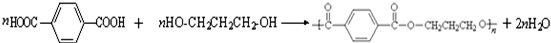 .
. ,请你设计出合理的反应流程图.
,请你设计出合理的反应流程图.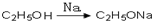 、
、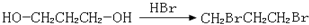 、
、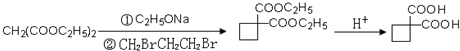 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
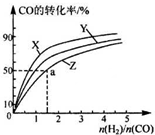 天然气、可燃冰的主要成分都是甲烷,甲烷既是一种清洁能源,又是一种重要的化工原料.
天然气、可燃冰的主要成分都是甲烷,甲烷既是一种清洁能源,又是一种重要的化工原料.| 温度(℃) | 800 | 1000 | 1200 | 1400 |
| 平衡常数(K) | 0.45 | 1.92 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2(SO4)3 | B. | 稀硫酸 | C. | AgNO3溶液 | D. | CuSO4 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M<N<Y<X<Z | B. | N<M<X<Y<Z | C. | N<M<Y<X<Z | D. | X<Z<N<M<Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- | |
| B. | 将氯气通入冷的氢氧化钠溶液中:Cl2+2OH-=Cl-+ClO-+H2O | |
| C. | 铝片与氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑ | |
| D. | NaHCO3溶液中加入盐酸:CO32-+2H+=H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com