
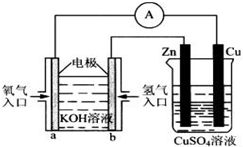
 Ⅰ.用碳棒作电极,电解下列水溶液:①Na2SO4溶液 ②AgNO3溶液 ③KCl溶液 ④CuCl2溶液.通过相同电量时,阴极产生的气体物质的量相同的是(填序号)
Ⅰ.用碳棒作电极,电解下列水溶液:①Na2SO4溶液 ②AgNO3溶液 ③KCl溶液 ④CuCl2溶液.通过相同电量时,阴极产生的气体物质的量相同的是(填序号)| 12.8g |
| 64g/mol |


科目:高中化学 来源:山西省实验中学2007-2008学年高三年级第一次月考试题、化学 题型:013
|
国外最新研制的溴——锌蓄电池的基本结构是用碳棒作两极,电解质是溴化锌溶液.现有四个电极反应: ①Zn-2e-=Zn2+ ②Zn2++2e-=Zn ③Br2+2e-=2Br- ④2Br--2e-=Br2 那么充电时的阳极反应和主电时的负极反应分别是 | |
| [ ] | |
A. |
④① |
B. |
②③ |
C. |
③① |
D. |
②④ |
查看答案和解析>>
科目:高中化学 来源:山西省实验中学2008届高三年级第一次月考化学试题 题型:013
|
国外最新研制的溴——锌蓄电池的基本结构是用碳棒作两极,电解质是溴化锌溶液.现有四个电极反应: ①Zn-2e-=Zn2+ ②Zn2++2e-=Zn ③Br2+2e-=2Br- ④2Br--2e-=Br2 那么充电时的阳极反应和主电时的负极反应分别是 | |
| [ ] | |
A. |
④① |
B. |
②③ |
C. |
③① |
D. |
②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com