
【题目】下列关系图中,A 是一种正盐,B 是气态氢化物,C 是单质,F 是强酸。当 X 无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当 X 是强碱时,过量的 B 跟 Cl2 反应除生成 C 外,另一产物是盐酸盐。
下列说法中不正确的是( )
![]()
A.当 X 是强酸时,A、B、C、D、E、F中均含同一种元素,F 可能是 H2SO4
B.当 X 是强碱时,A、B、C、D、E、F中均含同一种元素,F 是 HNO3
C.用 O2 代替 Cl2, 也能与 B 反应生成 C 物质
D.当 X 是强酸时,C 在常温下是一种易溶于酒精的固体
【答案】D
【解析】
当 X 是强碱时:和强碱反应产生的气态氢化物B可判断为NH3,则A为铵盐,过量的 B 跟 Cl2 反应生成的盐酸盐是NH4Cl,则C为N2,由此判断D为NO、E为NO2、F为HNO3;A和强酸反应生成的B能被Cl2氧化,且生成的C能被O2连续氧化,在常见的物质中可考虑A为硫化物,所以,当 X 是强酸时,A、B、C、D、E、F可分别为(NH4)2S、H2S、S、SO2、SO3、H2SO4。可在此基础上对各选项作出判断。
A. 当 X 是强酸时,A、B、C、D、E、F可分别为Na2S、H2S、S、SO2、SO3、H2SO4,它们均含S元素,A选项正确;
B. 当 X 是强碱时,A、B、C、D、E、F分别为(NH4)2S、NH3、N2、NO、NO2、HNO3,它们均含同一种元素N,B选项正确;
C. 用 O2 代替 Cl2:4NH3 + 3O2(纯氧) ![]() 2N2 + 6H2O,2H2S + O2(少量)
2N2 + 6H2O,2H2S + O2(少量) ![]() 2H2O + 2S↓,所以O2 也能与 B 反应生成 C 物质,C选项正确;
2H2O + 2S↓,所以O2 也能与 B 反应生成 C 物质,C选项正确;
D. 根据以上分析,当 X 是强酸时,C 为S,S在常温下是一种微溶于酒精的固体,D选项不正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】在一密闭容器内,充入0.8mol氢气和0.6mol碘蒸气,发生反应H2(g)+I2(g)![]() 2HI(g),反应中各物质浓度随时间变化正确的图像为
2HI(g),反应中各物质浓度随时间变化正确的图像为
A.  B.
B.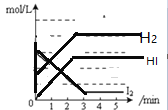
C.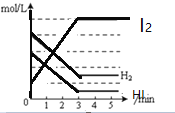 D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)(1)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:Bodensteins研究了下列反应:2HI(g)![]() H2(g) + I2(g)。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g) + I2(g)。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:___________。
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k正为________(以K和k逆表示)。若k正= 0.0027min-1,在t=40min时,v正=________min-1。
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_________________(填字母)。
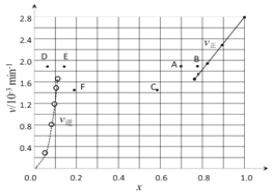
(二)常温下,将0.01 mol·L-1的Ba(OH)2溶液200mL和0.01 mol·L-1的NaHSO4溶液100mL混合,反应后溶液的pH值为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.因为 SO2 具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊溶液褪色
B.向 50 mL 18.4 mol/L H2SO4 溶液中加入足量的铜片并加热,充分反应后,被还原的 H2SO4的物质的量小于 0.46 mol
C.SO2、NO2 和 CO2 都是引起酸雨的主要原因,导致雨水的 pH 小于 5.6
D.浓 HNO3 与浓盐酸按 3∶1 的体积比混合所得的混合物叫王水,能溶解金和铂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】深井岩盐的主要配料为:精制盐、碘酸钾(KIO3)、亚铁氰化钾[K4Fe(CN)6·3H2O]。其中亚铁氰化钾的无水盐在高温下会发生分解:3K4[Fe(CN)6]![]() 2(CN)2↑+12KCN+N2↑+Fe3C+C。请回答下列问题:
2(CN)2↑+12KCN+N2↑+Fe3C+C。请回答下列问题:
(1)①基态Fe原子价电子排布图(轨道表示式)为_________________________
②C、N和O三种元素的第一电离能的大小顺序为_____________,原因是__________。
③IO3-的中心原子的杂化方式为______。一种与CN-互为等电子体的分子的电子式为_______。
④1molFe(CN)63中含有σ键的数目为____mol。
(2)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=___。Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于__________(填晶体类型)。
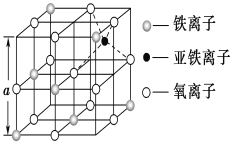
(3)如图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,该立方体中三价铁离子处于氧离子围成的________(填空间结构)空隙。
(4)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71gcm﹣3,晶胞边长为4.28×10﹣10 m,则FexO中x=____。(用代数式表示,不要求算出具体结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于水溶液中的离子平衡,下列说法正确的是
A.往![]() 稀溶液中加入NaOH固体,溶液中
稀溶液中加入NaOH固体,溶液中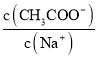 变大
变大
B.等物质的量浓度的![]() 、
、![]() 、
、![]() 三种溶液中,
三种溶液中,![]() 的大小顺序为:
的大小顺序为:![]()
C.常温下![]() 的
的![]() 溶液和
溶液和![]() 的NaOH溶液等体积混合,溶液中离子浓度大小顺序为:
的NaOH溶液等体积混合,溶液中离子浓度大小顺序为:![]()
D.![]() 的
的![]() 溶液中:
溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某![]() 、
、![]() 的混合溶液中加入少量的
的混合溶液中加入少量的![]() ,测得溶液中离子浓度的关系如图所示,下列说法正确的是
,测得溶液中离子浓度的关系如图所示,下列说法正确的是![]()
![]()
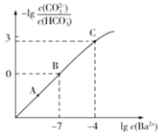
A.A,B,C三点对应溶液pH的大小顺序为:![]()
B.B点对应的溶液中存在:![]()
C.向C点溶液中通入![]() 可使C点溶液向B点溶液转化
可使C点溶液向B点溶液转化
D.该溶液中存在: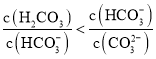
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是
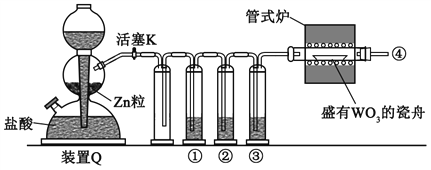
A. ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C. 结束反应时,先关闭活塞K,再停止加热
D. 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
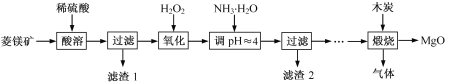
(1)MgCO3与稀硫酸反应的离子方程式为_______。
(2)加入H2O2氧化时,发生反应的化学方程式为_______。
(3)滤渣2 的成分是_______(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com