

分析 (1)②根据酸式滴定管和碱式滴定管的使用要求以及精确度来选择;
③根据化学方程式进行计算;
⑤比较化学反应速率,必须是比较一定时间之内的反应物浓度的变化或其它量的变化;(3)读数时要保持左右气体压强相等,以减少误差;
⑥读数时要保持左右气体压强相等,以减少误差;
(2)根据先冷却、再调整高度相等、最后读出量筒中体积的顺序排列即可;
(3)根据化学方程式进行计算产生气体体积,然后判断量筒规格;
(4)根据气体摩尔体积Vm=$\frac{V}{n}$进行计算;若仰视读数,则读出的读数偏小.
解答 解:(1)②题中要求酸的体积10.00 mL较精确,应选酸式滴定管,如用碱式滴定管会腐蚀橡胶管,
故答案为:酸式滴定管;
③Mg+2HCl(或HAc)═MgCl2+H2↑
24g 2 mol
a 1mol/L×0.01L
a=0.12 g.
故答案为:0.12;
⑤比较化学反应速率,必须是比较一定时间之内的反应物浓度的变化或其它量的变化,
故答案为:反应起止时间;
(2)应该先将溶液冷却到室温,然后使乙、丙中液面相平,最后读出量筒中溶液体积,所以正确顺序为:②①③,
故答案为:②①③;
(3)Mg+2HCl(或HAc)═MgCl2+H2↑
2 mol 1 mol
1 mol/L×0.01 L n(H2)
n(H2)=0.005 mol,V(H2)=0.005 mol×22.4L/mol=0.112L=112mL,应选200mL量筒,
故答案为:B;
(4)盐酸中氢离子的物质的量为:1mol/L×0.01L,生成氢气的物质的量为:$\frac{1}{2}$×1mol/L×0.01L,通过⑥的气体的体积为VmL=V×10-3L,Vm=$\frac{V}{n}$=$\frac{V×1{0}^{-3}L}{\frac{1}{2}×1mol/L×0.01L}$;若仰视读数,则读出的量筒内液体体积偏小,根据Vm=$\frac{V×1{0}^{-3}L}{\frac{1}{2}×1mol/L×0.01L}$可知,测定的气体摩尔体积偏小,
故答案为:$\frac{2×1{0}^{-3}VL}{1mol/L×0.01L}$;偏小.
点评 本题考查了体积影响化学反应速率的因素,题目难度中等,涉及化学方程式的计算、气体摩尔体积的计算、配制一定物质的量浓度的溶液方法、影响化学反应速率的因素等知识,试题知识点较多、综合性较强,充分考查学生的分析能力及化学实验、化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 冰融化时水分子中共价键发生断裂 | |
| B. | H2O2、PCl5都是含有极性键的非极性分子 | |
| C. | HF、HCl、HBr、HI的酸性依次增强 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
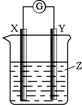
| A. | X是Zn,Y是Cu,Z为稀HCl溶液 | B. | X是Cu,Y是Zn,Z为稀H2SO4溶液 | ||
| C. | X是Cu,Y是石墨,Z为稀AgNO3溶液 | D. | X是石墨,Y是Fe,Z为稀AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
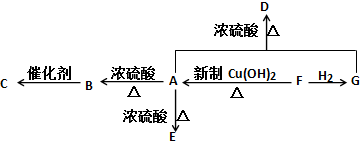
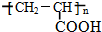 、GCH3CH(OH)CH2OH;
、GCH3CH(OH)CH2OH;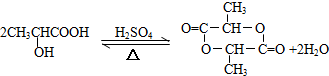 ;②F→A
;②F→A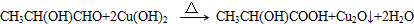 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度一定时,当溶液中c(Ba2+)×c(SO42-)=1.07×10-10时,此溶液为BaSO4的饱和溶液 | |
| B. | 因为Ksp(BaCO3)>Ksp(BaSO4),所以无法将BaSO4转化为BaCO3 | |
| C. | 25℃时,在未溶解完BaCO3的饱和溶液中滴入少量Na2SO4溶液后有BaSO4沉淀析出,此时溶液中c(CO32-):c(SO42-)=24.11 | |
| D. | 在饱和BaCO3溶液中加入少量Na2CO3固体,可使c(Ba2+)减小,BaCO3的溶度积不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
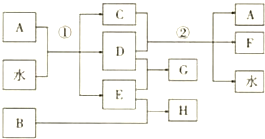
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3呈红棕色,可用做红色颜料 | |
| B. | 浓硫酸能腐蚀金属,不能用任何金属容器盛装浓硫酸 | |
| C. | 氯气有毒,利用这一性质可进行自来水的杀菌消毒 | |
| D. | 镁、铝都比较软,不能用做装饰材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯分子中不存在碳碳双键,所以不能发生加成反应 | |
| B. | 乙醇能发生氧化反应,乙酸则不可能发生氧化反应 | |
| C. | 乙酸和乙醇制乙酸乙酯与苯甲酸乙酯水解制苯甲酸和乙醇都属于取代反应 | |
| D. | 甲苯与氯气在光照下反应主要生成2,4-二氯甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 参数 | 比较 | 解释 |
| A | 沸点 | HF<HCl<HI | 组成结构相似的物质,相对分子质量越大沸点越高 |
| B | 半径 | Na+<Mg2+<Al3+ | 同一周期粒子半径随原子序数的递增逐渐减小 |
| C | 酸性 | H2SO3>H2CO3 | 元素的非金属性越强,其含氧酸的酸性越强 |
| D | 还原性 | P3->S2->Cl- | 元素的非金属性越强,简单阴离子的还原性越弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com