
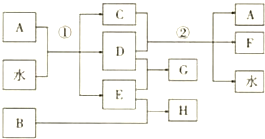
 ;
;分析 A、B、C、D、E、F、G、H八种物质是中学化学中常见的无机物,其中B、D、E是单质,通常状况下B是淡黄色固体和E单质反应生成H则判断B为S,D是黄绿色气体判断为Cl2,A、C和F的焰色反应,火焰均呈黄色说明都含有钠元素,D和F的水溶液都有漂白性.A+H2O反应生成D为Cl2,C和D反应生成的F具有漂白作用,证明C为NaOH,E为H2,A为NaCl,反应①是电解饱和食盐水,G为HCl,H为H2S,据此分析判断.
解答 解:A、B、C、D、E、F、G、H八种物质是中学化学中常见的无机物,其中B、D、E是单质,通常状况下B是淡黄色固体和E单质反应生成H则判断B为S,D是黄绿色气体判断为Cl2,A、C和F的焰色反应,火焰均呈黄色说明都含有钠元素,D和F的水溶液都有漂白性.A+H2O反应生成D为Cl2,C和D反应生成的F具有漂白作用,证明C为NaOH,F为NaClO,E为H2,A为NaCl,反应①是电解饱和食盐水,G为HCl,H为H2S,
(1)分析可知反应①是电解饱和食盐水,
故答案为:通电;
(2)H为H2S,C为氢氧化钠为离子化合物,电子式为: ,
,
故答案为:H2S, ;
;
(3)B为S属于第三周期第ⅥA族,G和H为HCl,H2S,稳定性比较,同周期氢化物稳定性增强,更稳定是HCl,
故答案为:第三周期第ⅥA族,HCl;
(4)F为NaClO,氯酸钠属于强碱弱酸盐,次氯酸根离子水解溶液显碱性,反应的离子方程式为:ClO-+H2O?HClO+OH-,
故答案为:碱性,ClO-+H2O?HClO+OH-;
(5)D为Cl2与一种固体碳酸盐及水按物质的量之比2:2:1发生反应,生成A为NaCl,则固体碳酸盐为碳酸钠,一种酸式盐为NaHCO3,生成的Y气体依据原子守恒配平得到为Cl2O,反应的化学方程式为:2Cl2+2Na2CO3+H2O=2NaCl+2NaHCO3+Cl2O,
故答案为:2Cl2+2Na2CO3+H2O=2NaCl+2NaHCO3+Cl2O.
点评 本题考查了物质转化关系的分析应用,主要是反应条件,物质性质的理解应用,过程分析和特征反应判断是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①③⑤⑥⑦ | C. | 只有①⑦ | D. | ③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、OH-、Cl- | B. | Na+、NH4+、Cl- | C. | Cu2+、K+、Cl- | D. | K+、SO32-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 物质X、Y、Z有如图转化关系:请回答下列问题:
物质X、Y、Z有如图转化关系:请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)第一电离能介于B、N之间的第二周期元素有3种.
(1)第一电离能介于B、N之间的第二周期元素有3种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和Na2CO3溶液中通入过量的CO2,溶液中无明显现象 | |
| B. | 检验某溶液是否含有SO${\;}_{4}^{2-}$时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 | |
| C. | 已知H+(aq)+OH-(aq)═H2O(l);△H=-57.3 kJ/mol.将4 g氢氧化钠固体放入100mL1mol/L的稀盐酸中,放出了5.73 kJ的热量 | |
| D. | 向100ml1mol/L的Ca(HCO3)2 溶液中加入等浓度等体积的NaOH溶液,溶液的碱性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com