
【题目】(1)下列各组化合物中,化学键类型和化合物类型均相同的是_________(填序号)。
①CaCl2和 Na2S ②Na2O 和 Na2O2 ③CO2和CaO ④HCl 和 NaOH
(2)下列过程不一定释放能量的是________。
①化合反应;②分解反应;③形成化学键;④燃料燃烧;⑤酸碱中和;⑥炸药爆炸
(3)Ba(OH)2 8H2O和NH4Cl反应的化学方程式是________________________________,反应过程能量变化的图像符合_____________(填“图1”或“图2”)。

图1 图2
(4)已知1 mol石墨转化为1 mol金刚石要吸收能量,则石墨比金刚石_______(填“稳定”或“不稳定”)。
(5)一定量的氢气在氧气中充分燃烧并放出热量。若生成气态水放出的热量为Q1,生成液态水放出的热量为Q2,那么Q1______Q2(填大于、小于或等于)。
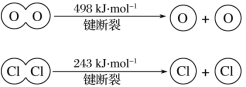
(6)已知:4HCl+O2=2Cl2+2H2O。该反应中,4 mol HCl被氧化,放出115.6 kJ的热量,且断开O=O键和Cl-Cl键所需的能量如下图所示。则断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为______ kJ。
【答案】① ①② Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O 图2 稳定 小于 31.9
【解析】
(1)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,第IA、第IIA族和第VIA、第VIIA族元素之间易形成离子键;
(2)根据吸热反应和放热反应的类别判断;
(3)Ba(OH)28H2O和NH4Cl反应生成氯化钡,氨气和水,属于吸热反应,判断合适的能量图;
(4)根据自身能量越低越稳定判断;
(5)根据气态水变成液态水放热判断;
(6)根据焓变等于断裂旧的化学键吸收的能量减去形成化学键释放的能量计算。
(1)①CaCl2和Na2S都属于离子化合物,都含有离子键,故①符合题意;
②Na2O和Na2O2都属于离子化合物,Na2O中存在离子键,Na2O2中含有离子键和非极性共价键,故②不符合题意;
③CO2属于共价化合物,主要含有共价键,CaO属于离子化合物,含有离子键;
④HCl属于共价化合物,主要含有共价键,NaOH属于离子化合物,含有离子键和极性共价键;
所以化学键类型和化合物类型均相同的是①;
(2)①绝大多数化合反应释放能量,少数化合反应吸收热量,例如碳和二氧化碳反应生成一氧化碳,故①符合题意;
②绝大多数分解反应吸收能量,少数化合反应释放能量,例如过氧化氢分解制氧气,故②符合题意;
③形成化学键一定释放能量,故③不符合题意;
④燃料燃烧一定释放能量,故④不符合题意;
⑤酸碱中和反应一定释放能量,故⑤不符合题意;
⑥炸药爆炸一定释放能量,故⑥不符合题意;
符合题意的是①②;
(3)Ba(OH)28H2O和NH4Cl反应的化学方程式是Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O,反应为吸热反应,即生成物的能量高于反应物的能量,能量图选择图2;
(4)已知1 mol石墨转化为1 mol金刚石要吸收能量,则石墨比金刚石能量低,能量越低的物质越稳定,石墨比金刚石稳定;
(5)一定量的氢气在氧气中充分燃烧生成气态水放出的热量为Q1,生成液态水放出的热量为Q2,由于气态水转化为液态水还要放热,故生成液态水释放的能量多,Q1小于Q2;
(6)根据化学反应:4HCl+O2=2Cl2+2H2O,放出115.6 kJ的热量,断开1molO=O键和1molCl-Cl键所需的能量分别为498kJ/mol和243kJ/mol,设断开1molH—O键需要的能量为x,断开1 mol H—Cl键所需能量为y,根据反应物断裂吸收的总能量与形成生成物释放的能量差等于反应放出的能量,4y+498kJ/mol-(243kJ/mol×2+4x)=-115.6 kJ,解得x-y=31.9kJ/mol,断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为31.9kJ。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】常温下,0.2 mol·L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是

A. HA为强酸
B. 该混合液pH=7
C. 图中X表示HA,Y表示OH-,Z表示H+
D. 该混合溶液中:c(A-)+c(Y)=0.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高聚物G可用于生产降解塑料,合成G的有关转化关系如下
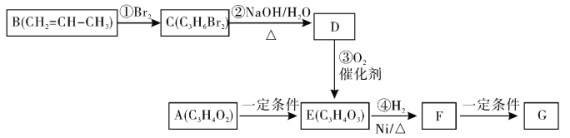
已知:物质A能够发生银镜反应,请回答下列问题:
(1)写出物质D的结构简式___________,C的名称为___________。
(2)F的官能团名称为___________。A→E的反应类型为:___________。
(3)下列说法正确的是___________(填字母序号)。
A.1molE与足量的H2在一定条件下发生反应,最多消耗2molH2
B. 1mol F与足量NaOH溶液反应,最多消耗1 molNaOH
C.物质B存在顺反异构体
D.D能使酸性高锰酸钾溶液褪色
(4)写出物质A发生银镜反应的化学方程式:_________________________________。
(5)写出F→G的化学方程式:_________________________________。
(6)化合物F有多种同分异构体,写出符合下列条件F的二种同分异构体的结构简式:____、_____。
①能与NaOH溶液反应;②能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学方程式或离子方程式,不正确的是
A.工业上可用电解法制备Mg:MgCl2(熔融) ![]() Mg + Cl2↑[
Mg + Cl2↑[
B.向Ca(ClO)2溶液中通入少量CO2:Ca2+ + 2ClO-+H2O+CO2 == 2HClO +CaCO3↓
C.用CaSO4治理盐碱地:CaSO4(s) + Na2CO3(aq) == CaCO3(s) + Na2SO4(aq)
D.用FeSO4除去酸性废水中的Cr2O72-:Cr2O72- + Fe2+ + 14H+ == 2Cr3+ + Fe3+ + 7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某反应过程中的能量变化如下图所示:
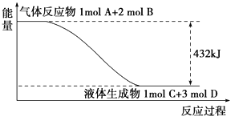
写出该反应的热化学方程式________。
(2)在溶液中进行的化学反应中的物质,其状态标为“aq”,已知1 molHCl在溶液中与足量氢氧化钠反应放出57.3 kJ的热量,用离子方程式写出该反应的热化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将久置在空气中的锌粒投人稀硫酸中,测得锌粒和硫酸反应产生氢气的速率v(H2)与反应时间t的关系曲线如图所示。下列推论不正确的是( )

A.O→a段由于是锌粒表面的氧化物与酸的反应,所以未产生气体
B.b→c段产生氢气的速率增大较快的主要原因是温度升高
C.c时刻反应生成的H2的量最多
D.c时刻之后产生氢气的速率减小的主要原因是溶液中c(H+ )减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图实验装置用于验证某些物质的性质。在试管A中装入足量的固体NaHCO3,D为固定蚊香的硬纸片。试回答下列问题:
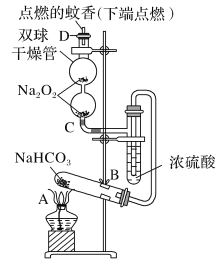
(1)在A试管内发生反应的化学方程式是_____。
(2)B装置的作用是_____。
(3)在双球干燥管内发生反应的化学方程式为____。
(4)双球干燥管内及D处观察到的实验现象是_____。
(5)若将干燥管内的Na2O2换成Na2O,则双球干燥管内及D处观察到的实验现象是:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 24 g 镁与27 g铝中,含有相同的质子数
B. 同等质量的氧气和臭氧中,电子数相同
C. 1 mol重水与1 mol水中,中子数比为2∶1
D. 1 mol乙烷和1 mol乙烯中,化学键数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
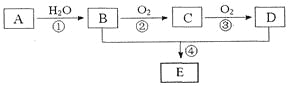
请回答下列问题:
(1)B、D分子中的官能团名称分别是__________、__________。
(2)写出下列反应的化学方程式,并注明反应类型:
②____________________,___________;④____________________,___________。
(3)在实验室利用B和D制备E的实验中,若用1mol B和1 mol D充分反应,能否生成1mol E_________,原因是__________。
(4)若184g B和120g D反应能生成106g E,则该反应的产率______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com