
�ӻ�ѧ���ĽǶȷ�������ѧ��Ӧ��ʵ���� ���������ĽǶȿ����Ͽ���ѧ��Ҫ ����ų������ߡ����ա����������γɻ�ѧ��Ҫ ����ų������ߡ����ա�����������ѧ��Ӧ���ͷ�����������������ȡ���� ������Ӧ��������� ������ڡ����ߡ����ڡ���������ʱ���÷�ӦΪ���ȷ�Ӧ������Ӧ��������� ������ڡ����ߡ����ڡ���������ʱ���÷�ӦΪ���ȷ�Ӧ�����磬H2��O2�е�ȼ����ˮ�Ĺ����У��Ͽ��Ļ�ѧ���� ���γɵĻ�ѧ���� ������֪�����DZ��ܹ�ע�������Դ��˵���÷�Ӧ�� ������ȡ����ߡ����ȡ�����Ӧ���Ӷ���֪2molH2��1molO2�������� ������ڡ����ߡ����ڡ���2mol H2O����������
�𰸣��ɻ�ѧ�����Ѻ��»�ѧ���γɣ����գ��ų����ɻ�ѧ���������յ��������»�ѧ���γɷų��������Ĵ�С�����ڣ����ڣ���������������������������ȣ����ڡ�
���������ʷ�����ѧ��Ӧ�������������ı仯��ԭ���Ǿɻ�ѧ���������յ��������»�ѧ���γɷų���������ͬ����һ��ȷ���Ļ�ѧ��Ӧ��ϵ�У���Ӧ�������������Ϊx�����������������(��Ϊy)֮��Ĺ�ϵΪ���ٷ��ȷ�Ӧ��x>y�������ȷ�Ӧ��x<y����Ȼ����������Դ��H2��O2�е�ȼ����ˮ�ķ�Ӧ��ȻΪ���ȷ�Ӧ��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| ��ѧ�� | H-H | N-H | N��N |
| ����/kJ?mol-1 | 436 | 391 | 945 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ��ѧ�� | H-H | N-H | N��N | ����/kJ?mol-1 | 436 | 391 | 946 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
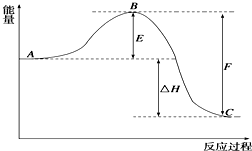 2SO2��g��+O2��g��?2SO3��g����Ӧ���̵������仯��ͼ��ʾ����֪1mol SO2��g������Ϊ1mol SO3��g���ġ�H1=-99kJ?mol-1
2SO2��g��+O2��g��?2SO3��g����Ӧ���̵������仯��ͼ��ʾ����֪1mol SO2��g������Ϊ1mol SO3��g���ġ�H1=-99kJ?mol-1�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��ѧ�� | H-H | N-H | N��N |
| ����/kJ?mol-1 | 436 | 391 | 946 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��ѧ�� | ���ܣ�kJ/mol�� | ��ѧ�� | ���ܣ�kJ/mol�� |
| N��N | 942 | H-O | 460 |
| N-H | 391 | O=O | 499 |
| H-H | 437 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com