
| ��ѧ�� | ���ܣ�kJ/mol�� | ��ѧ�� | ���ܣ�kJ/mol�� |
| N��N | 942 | H-O | 460 |
| N-H | 391 | O=O | 499 |
| H-H | 437 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
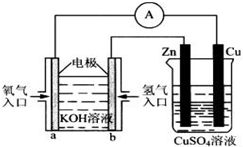 ����̼�����缫���������ˮ��Һ����Na2SO4��Һ ��AgNO3��Һ ��KCl��Һ ��CuCl2��Һ��ͨ����ͬ����ʱ�������������������ʵ�����ͬ���ǣ�����ţ�
����̼�����缫���������ˮ��Һ����Na2SO4��Һ ��AgNO3��Һ ��KCl��Һ ��CuCl2��Һ��ͨ����ͬ����ʱ�������������������ʵ�����ͬ���ǣ�����ţ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 1 |
| 2 |
| ��ѧ�� | ���ܣ�kJ/mol�� | ��ѧ�� | ���ܣ�kJ/mol�� |
| N��N | 942 | H-O | 460 |
| N-H | 391 | O=O | 499 |
| H-H | 437 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��09��10��̩����ѧ�߶���ѧ����ĩ���Ի�ѧ�� ���ͣ������
��8�֣���ĿǰΪֹ���ɻ�ѧ��ת������ܻ������Ȼ������ʹ������Ҫ����Դ��
��ش��������⣺
��2C2H2(g)��5O2(g)��4CO2(g)��2H2O(l) ��H����2599kJ��mol��1��
����Ȳ��ȼ����Ϊ�� �� ��
����Щ��Ӧ���еú�������Щ��Ӧ������ֱ�ӷ�������Щ��Ӧ�IJ�Ʒ�������и���Ӧ������������ⶨ��Ӧ����������ѣ���ʱ�����ø�˹���ɣ��Ϳ��Լ�ӵذ����ǵķ�Ӧ�ȼ����������֪
��CO(g)+1/2O2(g)=== CO2(g) ��H1=-283.0kJ��mol��1
��C(s)+O2(g)===CO2(g) ��H2=-393.5kJ��mol��1
��C(s)��1/2O2(g)="CO(g) " ��H = �� ��
�Ǵӻ�ѧ���ĽǶȷ�������ѧ��Ӧ�Ĺ��̾��Ƿ�Ӧ��Ļ�ѧ�����ƻ���������Ļ�ѧ�����γɹ��̡���֪�����������±���
| ��ѧ�� | ���ܣ�kJ/mol�� | ��ѧ�� | ���ܣ�kJ/mol�� |
| N��N | 942 | H��O | 460 |
| N��H | 391 | O��O | 499 |
| H��H | 437 | | |
 2NH3 ��H��a kJ��mol��1���Ը��ݱ������м������ݹ���a����ֵ �� ��
2NH3 ��H��a kJ��mol��1���Ը��ݱ������м������ݹ���a����ֵ �� ���鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com