
�����й�ʵ������������ͻ���۶���ȷ����
ѡ�� | ʵ����� | ���� | ���ͻ���� |
A | ���������Na2SiO3������Һ��Сľ�������ɺ���ھƾ���������� | Сľ����ȼ�� | Na2SiO3��������� |
B | ��H2�ٳ���Cl2�ļ���ƿ��ȼ�� | ����ƿ���Ϸ��а������� | H2��Cl2��������HCl |
C | ��SO2ͨ�����Ը��������Һ�� | ��Һ��ɫ | SO2����Ư���� |
D | ��ȥ��������Ĥ���������ھƾ����ϳ�ּ��� | �����ܵ������� | ���۵�ߣ�û���ۻ� |
A. A B. B C. C D. D
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�������ʡ�߶���ѧ�ڿ�ѧ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���Ȼ�����Һ�����������յò����Ȼ�������
�����ڳ�ʪ�Ŀ�������������
��ʵ���ҿ����ű���ʳ��ˮ�ķ����ռ�����
�ܳ����£���1 mL pH��3�Ĵ����ˮϡ����100 mL�������pH��5
�������Ȼ��ع����Ʊ��أ�Na(l)��KCl(l) K(g)��NaCl(l)
K(g)��NaCl(l)
����������������������ƽ����ϵ����ѹ����ɫ����
A. �٢ڢ� B. �ڢ� C. �٢ۢܢ� D. �ڢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ������ʡ�����и߶���ѧ����ĩ���ԣ�������ѧ�Ծ��������棩 ���ͣ�ѡ����

A. ��Ӧ��0��10 s�ڣ���Z��ʾ�ķ�Ӧ����Ϊ0��158 mol��L��1��s��1
B. ��Ӧ��0��10 s�ڣ�X�����ʵ���Ũ�ȼ�����0��79 mol��L��1
C. ��Ӧ���е�10 sʱ��Y��ת����Ϊ79.0%
D. ��Ӧ�Ļ�ѧ����ʽΪX(g)��Y(g)�PZ(g)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�������и�����Ӧ���¿����壩���ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ͼ��ʾװ�ý�������ʵ�飬a��b��c����װ�Լ����±���ʾ������ʵ����������۶�Ӧ��ϵ��ȷ��һ����

ѡ�� | a | b | c | ���� | ���� |
A | ����ʳ��ˮ | ̼���� | ��ˮ | c����Һ��ɫ��ȥ | ��Ȳ������ԭ��Ӧ |
B | Ũ���� | KMnO4���� | NaBr��Һ | c����Һ����ɫ���ɫ | Cl2�������Ա�Br2ǿ |
C | ϡ���� | ����ʯ | Na2SiO3��Һ | c���а�ɫ��״�������� | ̼������Աȹ���ǿ |
D | ���� | Na2SO3���� | ����KMnO4��Һ | c����Һ��ɫ��ȥ | SO2����Ư���� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ����3�¸߿���Ӧ�Բ������ۻ�ѧ�Ծ��������棩 ���ͣ������
��ˮMgBr2������������ʵ���Ҳ���þм��Һ��Ϊԭ���Ʊ���ˮMgBr2��װ������ͼ��ʾ���г�������ȥ������Ҫ�������£�

����l������ƿ��װ��10gþм��150mL��ˮ���ѣ�װ��B�м���������Һ�塣
����2������ͨ�����ĵ�����ֱ������ȫ��������ƿ�С�
����3����Ӧ��Ϻ�ָ������£����ˣ�����Һת������һ�������ƿ�У���ȴ��0�棬�������壬�ٹ��˵������Ѻ��廯þ��Ʒ��
����4���������ñ��ܽ��Ʒ����ȴ��0�棬�������壬���ˣ�ϴ�ӵ������Ѻ��廯þ��������160��ֽ����ˮMgBr2��Ʒ��
��֪����Mg��Br2��Ӧ���ҷ��ȣ�MgBr2����ǿ��ˮ�ԡ�
��MgBr2+3C2H5OC2H5= MgBr2��3C2H5OC2H5
��ش�
(1)����A��������___________������ʵ���е�������____________��
(2)����2�У����Խ�Bװ���е�����ȫ��������ƿ�е�ԭ����_______����ʵ�����������Һ��һ����ȫ����������ƿ�У�������_____________��
(3)����3�У���һ�ι��˵õ��Ĺ���������______�����ݲ���3��4�����ܽ�������Ѻ��廯þ�����е��������ʣ�_________��
(4)�����Mg���������ʵ��֤��O2�������Ա�N2��ǿ��________��
(5)������õ��IJ�Ʒ�ڸ���������ȴ�����º�����������Ϊ61.4g�����ʵ����ȡMgBr2�IJ�����_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ�����и����ڶ����ʼ컯ѧ�Ծ��������棩 ���ͣ������
����������(Na2S2O5)��һ��ʳƷ���Ӽ���ʵ��������ͼ1��ʾװ���Ʊ�Na2S2O5��ʵ�鲽�����£�
����Na2CO3��Һ��ͨ��SO2��pHΪ4.1������NaHSO3��Һ��
��̼���Ʒ�ĩ����pHΪ7��8��
����ͨSO2��pHΪ4.1��
�����ӹ�������Һ������Na2S2O5���壮
(1)�Ʊ������������ܷ�Ӧ�Ļ�ѧ����ʽΪ ��
(2)Na2S2O5����ˮ����ˮ�ܷ�Ӧ��������Һ�����ԣ���ԭ���� ��������вⶨ��Һ��pH�ķ����� ��pH��4.1ʱ�����Ʒ�л��и�����仯ѧʽ�� ��
(3)���õ������ɲⶨNa2S2O5��Ʒ��+4����ĺ�����ʵ�鷽��Ϊ����һ������Na2S2O5��Ʒ�������ƿ(��ĥ��������ƿ)�У� ���ظ����ϲ���2�Σ���¼���ݣ�(ʵ���б���ʹ�õ��Լ��У�c1mol•L��1�ı�����Һ��c2mol•L��1�ı�Na2S2O3��Һ�������ᡢ������Һ������ˮ����֪��2Na2S2O3+I2�TNa2S4O6+2NaI)
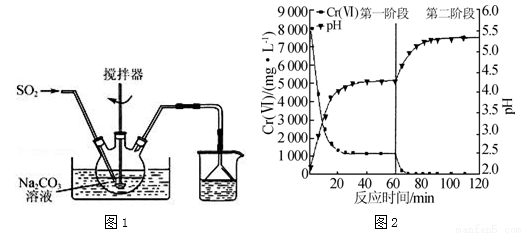
(4)������ˮ�г��������۸�[Cr(��)]������Na2S2O5��FeSO4•7H2O�Ⱥ�������δ�����Cr2O72���ķ�ˮ��ʵ������ͼ��
��ʵ���������Һ��pH�������ߵ�ԭ���� ��
����֪��Ksp[Cr(OH)3]=6.4��10��31��lg2��0.3��c(Cr3+)��1.0��10��5mol•L��1ʱ��Ϊ��ȫ�������ֽ���ˮ��Cr2O72��ȫ��ת��ΪCr(OH)3����ȥ���������Һ��pH��ΧΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ�����и����ڶ����ʼ컯ѧ�Ծ��������棩 ���ͣ�ѡ����
ijƷ�ƻ�ױƷ����Ҫ�ɷ�Z��������Ч��ԭ����������ȡ���ֿ�������ͼ��ʾ��Ӧ�ϳɡ����ж�X��Y��Z����������ȷ����

A. X��Y��Z���ܺ�NaOH��Һ��Ӧ
B. X��Z���ܺ�Na2CO3��Һ��Ӧ�������ܺ�NaHCO3��Һ��Ӧ
C. Y���ܷ����Ӿ۷�Ӧ��Ҳ�ܷ������۷�Ӧ
D. Y����������ԭ�Ӳ����ܹ�ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016~2017ѧ�꽭��ʡ��Ǩ�и߶�ѧҵˮƽ����ģ�⣨������ѧ�Ծ��������棩 ���ͣ�ѡ����
X��Y��Z��W��RΪ���ֶ���������Ԫ�أ���ԭ������������������ԭ������������֮��Ϊ19��X��ԭ�Ӱ뾶��Y��С��X��Wͬ���壬Z��Rͬ���壬Z�ǵؿ��к�����ߵ�Ԫ�ء�����˵����ȷ����
A. ԭ�Ӱ뾶�Ĵ�С˳��r(Y)>r(Z)>r(W)
B. R���������Ӧ��ˮ����Ϊǿ��
C. Ԫ��Y�ļ���̬�⻯������ȶ��Ա�Z����
D. X��Y��Z����Ԫ��ֻ���γɹ��ۻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��㶫ʡտ���и߶���ѧ����ĩ���п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪�����£�KSP(AgCl)=1.8��10-10 mol2��L-2��KSP(AgI)=8.3��10-17mol2��L-2�����������У� ��ȷ����
A. �����£�AgCl �ڱ��� NaCl ��Һ�е� KSP ���ڴ�ˮ�е� KSP С
B. �� AgCl ������Һ�м��� KI ��Һ�������ɰ�ɫת��Ϊ��ɫ
C. �� AgCl �ı�����Һ�м��� NaCl ���壬�� AgCl ��������Һ�� c(Ag+)=c(Cl-)
D. �� 0.001 mol��L-1 �� AgNO3 ��Һ���� KCl �� KI �Ļ����Һ�У�һ���Ȳ��� AgI ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com