
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:在一定温度下发生下列反应:
①NH4I(s) NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g) H2(g)+I2(g)达到平衡时,C(H2)=0.5mol•L-1,c(HI)=3mol•L-1,则此温度下反应①的平衡常数为
H2(g)+I2(g)达到平衡时,C(H2)=0.5mol•L-1,c(HI)=3mol•L-1,则此温度下反应①的平衡常数为
A.12 B.16 C.20 D.25
 考前必练系列答案
考前必练系列答案科目:高中化学 来源:2016-2017学年黑龙江省高二上学期期中化学试卷(解析版) 题型:选择题
已知25 ℃时,几种弱酸的电离常数如下:
弱酸的化学式 | CH3COOH | HCN | H2S |
电离常数 | 1.8×10-5 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
25 ℃时,下列说法正确的是( )
A.用0.1mol/LNaOH溶液滴定pH值相等CH3COOH和HCN溶液,CH3COOH消耗的NaOH溶液体积更大
B.等物质的量浓度的各溶液pH关系为:pH(Na2S)>pH(NaCN) >pH(NaHS)>pH(CH3COONa)
C.NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)+c(H2S)
D.某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-d mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省邯郸市、永年二中高二上期中化学卷(解析版) 题型:填空题
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应 来合成甲醇(于固定容器中进行):2H2(g) + CO(g)
来合成甲醇(于固定容器中进行):2H2(g) + CO(g) CH3OH(g)
CH3OH(g)
(1)下表所列数据是该反应在不同温度下的化学平衡常数(K)
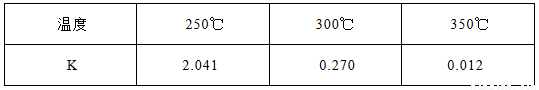
①该反应的熵变△S 0(填:“<,>,=”)。该反应在 (填:高温或低温)条件下能自发进行。
②要提高CO的转化率,可以采取的措施是_____________(填序号)。
a.升温
b.加入催化剂
c.增加CO的浓度
d.加入H2加压
e.加入惰性气体加压
f.分离出甲醇
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A__________C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A___________C,由状态B到状态A,可采用___________的方法(填“升温”或“降温”)。

查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省邯郸市、永年二中高二上期中化学卷(解析版) 题型:选择题
下列叙述不正确的是( )
A.原电池是将化学能转化为电能的装置
B.铁船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁腐蚀的负极反应:Fe﹣3e﹣═Fe3+
D.把锌片放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上期中化学试卷(解析版) 题型:填空题
“嫦娥一号”探月成功,实现了中国人奔月的梦想
(1)“嫦娥一号”使用的推进剂是液氢和液氧,这种推进剂的优点除产生的热量大之外,还具有的优点是_______________________。
(2)下列是298K时,氢气(H2)、碳(C)、辛烷(C8H18)、甲烷(CH4)燃烧的热化学方程式:
H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ/mol
C(g)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l) ΔH=-5518 kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol
相同质量的H2、C、C8H18、CH4完全燃烧时,放出热量最多的是________________。
(3)已知:H2(g)=H2(l) ΔH=-0.92 kJ/mol
O2(g)=O2(l) ΔH=-6.84 kJ/mol
H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
请写出液氢和液氧生成气态水的热化学方程式_______________。如果此次“嫦娥一号”所携带的燃料为1.08吨,液氢、液氧恰好完全反应生成气态水,总共释放能量___________kJ(保留3位有效数字)。
(4)氢气、氧气不仅燃烧时能释放热能,二者形成的原电池还能提供电能,美国的探月飞船“阿波罗号”使用的就是氢氧燃料电池,电解液为KOH溶液,其电池反应为:负极放电的物质为__________________,正极:__________________,总反应式:__________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上期中化学试卷(解析版) 题型:选择题
下列事实不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C.反应CO(g)+NO2(g) CO2(g)+NO(g)(正反应为放热反应),达平衡后,升温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升温度体系颜色变深
D.对于2HI(g) H2(g)+I2(g),达平衡后,缩小容器体积可使体系频色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系频色变深
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上期中化学试卷(解析版) 题型:选择题
充分燃烧一定量的丁烷生成CO2和液态水,放热QkJ,经测定生成的CO2恰好被100mL 5mol/L的KOH溶液吸收生成KHCO3,则热化学方程式:C4H10(g)+6.5O2(g)=4CO2(g)+5H2O(l)的ΔH为
A.-16QkJ/mol B.+16QkJ/mol C.-8QkJ/mol D.+8QkJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一上期中化学试卷(解析版) 题型:选择题
氧化还原反应与四种基本反应类型的关系如图所示。下列化学反应属于阴影部分的是( )
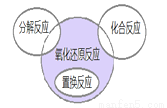
A.4Fe(OH)2+O2+2H2O=4Fe(OH)3
B.4NH3 +5O2 4NO+6H2O
4NO+6H2O
C.2NaHCO3=Na2CO3+H2O+CO2↑
D.Cl2+2NaBr=2NaCl+Br2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南师大附中高一上期中化学试卷(解析版) 题型:选择题
密度为0.910 g·cm-3的氨水,质量分数为25.0%,该氨水用等体积的水稀释后,所得溶液的质量分数为
A.等于12.5% B.大于12.5% C.小于12.5% D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com