
下列说法正确的是
A. 探究温度对反应速率的影响时,应先将硫代硫酸钠溶液、硫酸溶液分别在水浴中加热,然后混合
B. 等物质的量的Ba(OH)2溶液与NaHCO3溶液反应离子方程式可表示为:Ba2++2OH-+2HCO3-= BaCO3↓+2H2O+CO32-
C. 常温下,将BaSO4投入饱和Na2CO3溶液中充分反应,向过滤后所得固体中加入足量盐酸,固体部分溶解有无色无味气体产生,则说明常温下Ksp(BaSO4) > Ksp(BaCO3)
D. Hg(l)+H2SO4(aq)=HgSO4(aq)+H2(g)常温下不能自发进行,说明ΔH<0
科目:高中化学 来源:2017届贵州省贵阳市高三下学期第六次适应性考试理综化学试卷(解析版) 题型:简答题
热化学和各类平衡等都是化学研究的对象
(1)已知:①2O2(g)+N2(g)==N2O4(l) △H1;
②N2(g)+2H2(g)==N2H4(g) △H2;
③O2(g)+2H2(g)==2H2O(g) △H3;
④2N2H4(g) +N2O4(1)==3N2(g)+4H2O(g) △H4。
上述反成热效应之间的关系式为△H4 =_______(用含△H1、△H2、△H3的代数式表示)。
(2)将不同量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g)  H2(g)+CO2(g),得到如下表三组数据:
H2(g)+CO2(g),得到如下表三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | |||
H2O | CO | H2 | CO | ||||
1 | 800 | 2 | 4 | 4/3 | 8/3 | 6 | |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 | |
3 | 900 | a | b | c | d | t | |
①该反应的逆反应为______(填“吸热”或“放热”)反应;实验2的平衡常数K=________。
②若实验3达到平衡时与实验2达到平衡状态时各物质的体积分数分别相等,且t<3,则a、b应满足的关系是_______(用含a、b的代数式表示)。
③若保持温度和容积不变,向实验1再增加4molH2O(g),使反应达到新的平衡。下列说法不正确的是______(填序号)。
A.新、旧平衡时容器内气体的压强之比是5 : 3
B.新平衡时H2O的转化率增大
C.新平衡时CO的浓度是0.8 mol·L-l
D.新、旧平衡时容器内气体密度之比为5 : 3
(3)室温下,用0.1 mol·L-l的KOH溶液滴定10.00Ml0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:

a.点②所示溶液中的电荷守恒式为________________________。
b.点③所示溶液中所有离子的浓度由大到小的顺序为___________________。
c.成④所示溶液中c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=________mol/L。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三(实验班)第十次月考理综化学试卷(解析版) 题型:选择题
下列叙述错误的是( )
A. 过程的自发性只能用于判断过程的方向性,不能确定过程是否一定会发生和过程发生的速率
B. 空气污染日报中的空气污染指数的主要项目有可吸入颗粒物、二氧化硫、二氧化氮
C. 金属冶炼过程主要是利用金属矿物中的金属离子失去电子变成金属单质所发生的氧化还原反应
D. 糖类和油脂是重要的基本营养物质,并且是人体所需能量的重要来源
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二3月月考化学试卷(解析版) 题型:选择题
在给定条件下,下列离子组能否大量共存的判断及对应的离子方程式书写都正确的是( )
条 件 | 离 子 组 | 离子共存判断及反应的离子方程式 | |
A | 滴加NaCl溶液 | K+、Al3+、SO42-、AlO2- | 不能大量共存 Al3++3AlO2-+6H2O═4Al(OH)3↓ |
B | 通入CO2, | Na+、K+、 C6H5O-、CH3COO- | 不能大量共存,2C6H5O-+CO2+H2O=2C6H5OH+CO32- |
C | 常温下由水电离出的H+浓度为1×10-12mol•L-1的溶液 | Fe2+、Na+、Cl-、NO3- | 可能大量共存 |
D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能大量共存,2ClO-+SO2+H2O═2HClO+SO32- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三下学期第一次月考化学试卷(解析版) 题型:实验题
通过沉淀-氧化法处理含铬废水,减少废液排放对环境的污染,同时回收K2Cr2O7。
实验室对含铬废液(含有Cr3+、Fe3+、K+、SO42-、NO3-和少量Cr2O72-)回收与再利用工艺如下:
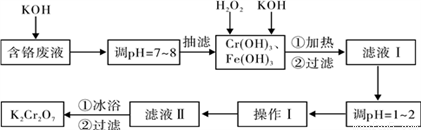
已知:①Cr(OH)3 + OH- = CrO2- + 2H2O;
②2CrO2- + 3H2O2 + 2OH- = 2CrO42- + 4H2O;
③H2O2在酸性条件下具有还原性,能将+6价Cr还原为+3价Cr。
(1)如图是用KOH固体配制250mL 6 mol·L-1 KOH溶液的过程示意图。
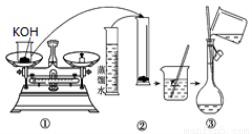
①请你观察图示判断,其中不正确的操作有(填序号)_____________________;
②其中配制250 mL溶液体积的容器是(填名称)_________________;
③如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
(2)滤液Ⅰ酸化前,进行加热的目的是_________________。冰浴、过滤后,应用少量冷水洗涤K2Cr2O7,其目的是_______。
(3)下表是相关物质的溶解度数据:
物质 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 | 56.3 |
K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 | 24.1 |
K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 | 102.0 |
KNO3 | 13.9 | 31.6 | 61.3 | 106 | 167 | 246.0 |
根据溶解度数据,操作Ⅰ具体操作步骤为①________________②________________。
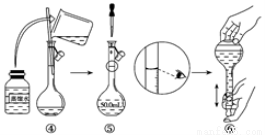
称取产品重铬酸钾试样2.000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2mol·L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200 mol·L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①写出重铬酸钾氧化碘化钠的离子方程式___________________。
②滴定终点的现象为___________________。
③若实验中共用去Na2S2O3标准溶液30.00mL,所得产品中的重铬酸钾的纯度 为_________(设整个过程中其它杂质不参与反应)。
④若滴定管在使用前未用Na2S2O3标准溶液润洗,测得的重铬酸钾的纯度将_____________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一3月月考化学试卷(解析版) 题型:实验题
为验证卤素单质氧化性的相对较弱,某小组用下图装置进行实验(夹持仪器已略去,气密性已检验)。实验过程:

Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸,A中产生黄绿色气体。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)D中四氯化碳的电子式是 。
(2)验证氯气的氧化性强于碘的实验现象是 。
(3)B中溶液发生反应的离子方程式是 。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 。
(5)过程Ⅲ实验的目的是 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一3月月考化学试卷(解析版) 题型:选择题
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是( )
A. X、Y、Z、W的原子半径依次减小
B. W与X形成的化合物中只含离子键
C. W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D. 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
科目:高中化学 来源:海南省、文昌中学2017届高三下学期联考化学试卷 题型:填空题
氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为___________________。
(2)氢气能源有很多优点,佴是氢气直接燃烧的能量转化率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:_______________________________________。
(3)在一定条件下,1mol某金属氢化物MHX与ymolH2发生储氢反应生成1 mol新的金属氢化物,写出该反应的化学反应方程式:___________________________________。
(4)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH? FeO42?+3H2↑,工作原理如图所示。装置通电后,铁电极附近生成紫红色的FeO42?,镍电极有气泡产生。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42?+3H2↑,工作原理如图所示。装置通电后,铁电极附近生成紫红色的FeO42?,镍电极有气泡产生。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解一段时间后,c(OH?)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_______。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都市北湖校区高二3月月考化学试卷(解析版) 题型:选择题
下列有关金属晶体的说法错误的是( )
A. 温度越高,金属的导电性越差
B. 金属晶体中非密置层在三维空间可形成两种堆积方式,其配位数都是6
C. 镁型堆积和铜型堆积是密置层在三维空间形成的两种堆积方式,其配位数都是12
D. 金属离子与自由电子之间的强烈作用,在一定外力作用下,不因形变而消失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com