
【题目】现有A、B、C、D、E、F、G 七种原子序数依次增大的元素,其中前六种属于短周期主族元素。A与 B可构成三核10电子的分子;E 原子的核外电子数是 B 原子的核内质子数的2倍;C、D、F同周期,且它们的最高价氧化物的水化物两两之间相互发生复分解反应;G的一种氧化物常作红色油漆的颜料。
(1)F 形成的单核阴离子的电子式为__________________。
(2)M是由 A、B、C组成的常见化合物,M中的化学键类型有______________。
(3)向C、D的最高价氧化物的水化物相互反应后的溶液中缓慢滴加盐酸至过量,产生的现象是___,反应的离子方程式为______,G 的单质与水蒸气反应的化学方程式为______。
【答案】![]() 离子键,极性共价键 刚开始有白色沉淀产生,后又逐渐溶解 AlO2+H++H2O=Al(OH)3,Al(OH)33H3H2OAl3 Fe4H2O(g)
离子键,极性共价键 刚开始有白色沉淀产生,后又逐渐溶解 AlO2+H++H2O=Al(OH)3,Al(OH)33H3H2OAl3 Fe4H2O(g)![]() Fe3O44H2
Fe3O44H2
【解析】
A与B构成三核10电子的分子,即A为H,B为O,E的原子核外电子数是B原子的核内质子数的2倍,则E为S,A、B、C、D、E、F属于短周期元素,原子序数依次增大,C、D、F同周期,且它们的最高价氧化物的水化物两两之间相互发生复分解反应,推出C为Na,D为Al,F为Cl,G的一种氧化物常作红色油漆的颜料,G为Fe,据此分析。
A与B构成三核10电子的分子,即A为H,B为O,E的原子核外电子数是B原子的核内质子数的2倍,则E为S,A、B、C、D、E、F属于短周期元素,原子序数依次增大,C、D、F同周期,且它们的最高价氧化物的水化物两两之间相互发生复分解反应,推出C为Na,D为Al,F为Cl,G的一种氧化物常作红色油漆的颜料,G为Fe。
(1)F为Cl,形成的单核阴离子的电子式为![]() ;
;
(2)M是由 A、B、C组成的常见化合物NaOH,NaOH中的化学键类型有离子键、极性共价键;
(3)向C、D的最高价氧化物的水化物氢氧化钠和氢氧化铝相互反应后的溶液偏铝酸钠溶液中缓慢滴加盐酸至过量,产生的现象是刚开始有白色沉淀产生,后又逐渐溶解,反应的离子方程式为AlO2+H++H2O=Al(OH)3,Al(OH)33H3H2OAl3,G 的单质Fe与水蒸气反应生成四氧化三铁和氢气,反应的化学方程式为Fe4H2O(g)![]() Fe3O44H2。
Fe3O44H2。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
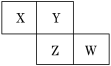
A. X的最常见气态氢化物的水溶液显酸性
B. 最高价氧化物对应水化物的酸性W比Z强
C. Z的单质与氢气反应比Y单质与氢气反应剧烈
D. X的原子半径小于Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(4分)下列应用不涉及氧化还原反应的是( )
A. Na2O2用作呼吸面具的供氧剂
B. 工业上电解熔融状态的Al2O3制备Al
C. 工业上利用合成氨实现人工固氮
D. 实验室用NH4Cl和Ca(OH)2制备NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
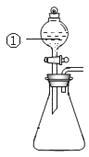
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氨酯类高分子材料PU用途广泛,其合成反应为:
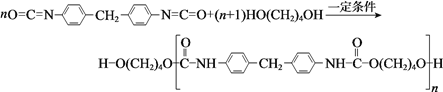
下列说法不正确的是
A. HO(CH2)4OH的沸点高于CH3CH2CH2CH3
B. 高分子材料PU在强酸、强碱中能稳定存在
C. 合成PU的两种单体的核磁共振氢谱中均有3个吸收峰
D. 以1,3-丁二烯为原料,可合成HO(CH2)4OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,将三个分别盛满氨气、氯化氢、二氧化氮的等容积烧瓶倒置于盛有水的水槽中,当水进入烧瓶中,并使气体充分溶解后(假设烧瓶中的溶液不向外扩散),三种溶液的物质的量浓度之比为( )
A. 1∶1∶1B. 3∶3∶2
C. 1∶2∶3D. 1∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾 (K2Cr2O7),其工艺流程及相关物质溶解度曲线如下图所示。
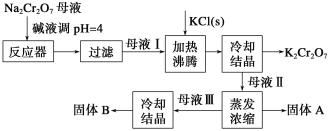
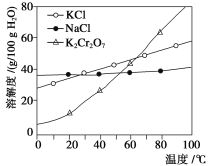
(1)向Na2Cr2O7母液中加碱液调pH的目的是_____________________。
(2)通过冷却结晶析出大量K2Cr2O7的原因是________________________________。
(3)固体A的主要成分为__________(填化学式),用热水洗涤固体A,回收的洗涤液转移到母液___________(填“I”“Ⅱ”或“Ⅲ”)中,既能提高产率又可使能耗降低。
(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.500 g 配成250 mL溶液,用移液管取出25.00 mL于碘量瓶中,加入10 mL 2 mol·L-l H2SO4溶液和足量KI溶液(铬的还原产物为Cr3+),放置于暗处5 min,然后加入100 mL蒸馏水、3 mL 淀粉指示剂,用0.1200 mol·L-l Na2S2O3标准溶液滴定(已知I2+ 2S2O32-=2I-+S4O62-)。
①酸性溶液中KI 与K2Cr2O7反应的离子方程式为_____________________________。
②若实验中共用去Na2S2O3标准溶液40.00 mL,则所得产品中重铬酸钾的纯度为__________%( 保留2 位小数,设整个过程中其他杂质不参与反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断开1molH2(g)中H-H键需要吸收436kJ能量,根据能量变化示意图,下列说法或热化学方程式不正确的是( )
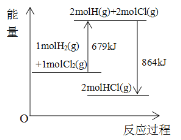
A. 断开1molHCl(g)中H-Cl键要吸收432kJ能量
B. 生成1molCl2(g)中的Cl-Cl键放出243kJ能量
C. HCl(g)→1/2H2(g)+1/2Cl2(g)-92.5kJ
D. H2(g)+Cl2(g)→2HCl(g)+864kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com