
【题目】已知断开1molH2(g)中H-H键需要吸收436kJ能量,根据能量变化示意图,下列说法或热化学方程式不正确的是( )
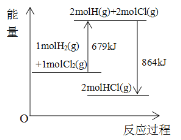
A. 断开1molHCl(g)中H-Cl键要吸收432kJ能量
B. 生成1molCl2(g)中的Cl-Cl键放出243kJ能量
C. HCl(g)→1/2H2(g)+1/2Cl2(g)-92.5kJ
D. H2(g)+Cl2(g)→2HCl(g)+864kJ
【答案】D
【解析】
A. 根据图示可知,生成2 mol HCl(g)需要放出864kJ热量,则断开2 mol HCl(g)需要吸收864kJ热量,由此推出断开1molHCl(g)中H-Cl键要吸收![]() = 432 kJ能量,A项正确;
= 432 kJ能量,A项正确;
B. 由图中可以写出其热反应方程式为:H2(g) +Cl2(g) = 2HCl(g) ΔH=-185 kJ·mol-1,根据ΔH=E(H-H) + E(Cl- Cl)-2 E(H- Cl)可知,E(Cl- Cl) = 243 kJ·mol-1,即生成1molCl2(g)中的Cl-Cl键放出243kJ能量,B项正确;
C. 根据图示信息易知,H2(g) +Cl2(g) = 2HCl(g) ΔH=-185 kJ·mol-1,则HCl(g)→1/2H2(g)+1/2Cl2(g) ΔH=+92.5 kJ·mol-1,即HCl(g)→1/2H2(g)+1/2Cl2(g)-92.5kJ, C项正确;
D. 生成2 mol HCl(g)需要放出864kJ热量,所以H2(g)+Cl2(g)→2HCl(g)-864kJ,D项错误;
答案选D。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F、G 七种原子序数依次增大的元素,其中前六种属于短周期主族元素。A与 B可构成三核10电子的分子;E 原子的核外电子数是 B 原子的核内质子数的2倍;C、D、F同周期,且它们的最高价氧化物的水化物两两之间相互发生复分解反应;G的一种氧化物常作红色油漆的颜料。
(1)F 形成的单核阴离子的电子式为__________________。
(2)M是由 A、B、C组成的常见化合物,M中的化学键类型有______________。
(3)向C、D的最高价氧化物的水化物相互反应后的溶液中缓慢滴加盐酸至过量,产生的现象是___,反应的离子方程式为______,G 的单质与水蒸气反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机分子中,所有的原子不可能处于同一平面的是( )
A. CH2==CH2 B. CH2==CH—CH==CH2
C. CH2==C(CH3)—CH==CH2 D. CH2==CH—C≡CH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组进行实验:向硫酸酸化的过氧化氢溶液中加入碘化钾、淀粉和硫代硫酸钠的混合溶液,一段时间后溶液变蓝。查阅资料知体系中存在两个主要反应:
反应i:H2O2(aq) + 2I-(aq) + 2H+(aq) I2(aq) + 2H2O(l) ΔH1 = -247.5 kJ/mol
反应ii:I2(aq) + 2S2O32-(aq) 2I-(aq) + S4O62-(aq) ΔH2 = -1021.6 kJ/mol
(1)H2O2与S2O32-反应的热化学方程式为______。
(2)下列实验方案可证实上述反应过程。将实验方案补充完整(所用试剂浓度均为0.01 mol/L)。
a.向酸化的H2O2溶液中加入________溶液,溶液几秒后变为蓝色。
b._________,溶液立即褪色。
(3)探究c(H+)对反应速率的影响,实验方案如下表所示。(所用试剂除H2O以外,浓度均为0.01 mol/L)
实验序号 | a | b | |
试 剂 | H2O2/mL | 5 | ______ |
H2SO4/mL | 4 | 2 | |
Na2S2O3/mL | 8 | _____ | |
KI(含淀粉)/mL | 3 | _____ | |
H2O | 0 | ______ | |
将上述溶液迅速混合 观察现象 | 溶液变蓝所需时间 为t1秒 | 溶液变蓝所需时间 为t2秒 | |
① 将实验b补充完整。
② 对比实验a和实验b,t1_____t2(填“>”或“<”)。
③ 结合(2)中现象解释溶液混合后一段时间才变蓝的原因________。
④ 利用实验a的数据,计算t1时间内H2O2与S2O32-反应的平均反应速率(用H2O2浓度的变化表示)________mol/(L·s)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:Ⅰ.2SO2(g) + O2(g)![]() 2SO3(g)ΔH=-196.6 kJ· mol-1
2SO3(g)ΔH=-196.6 kJ· mol-1
Ⅱ.2NO(g) + O2(g) ![]() 2NO2(g)ΔH=-113.0 kJ· mol-1
2NO2(g)ΔH=-113.0 kJ· mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=____kJ· mol-1。
SO3(g)+NO(g)的ΔH=____kJ· mol-1。
(2)一定条件下,将NO2(g)与SO2(g)以体积比2∶1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是____。
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变 D.每消耗1 mol SO3的同时生成1 mol NO
(3)CO可用于合成甲醇,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图甲所示,该反应的ΔH____0(填“>”或“<”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图甲所示,该反应的ΔH____0(填“>”或“<”)。

(4)依据燃烧的反应原理,合成的甲醇可以设计成如图乙所示的原电池装置。
①该电池工作时,OH-向____(填“正”或“负”)极移动。
②该电池正极的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从经济效益和环境保护的观点出发,由铜制取硝酸铜最适宜的方法是
A. Cu与浓HNO3―→Cu(NO3)2
B. Cu与稀HNO3―→Cu(NO3)2
C. Cu![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
D. Cu+AgNO3―→Cu(NO3)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com