
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.1 L0.1 mol·L-1的氨水中含有的NH3 分子数为 0.1 NA
B.标准状况下, 2.24 L 的 CCl4 中含有的 C-Cl 键数为 0.4 NA
C.14 g 由乙烯与环丙烧 ( C3H6) 组成的混合气体含有的碳原子数目为NA
D.常温常压下, Fe 与足量稀盐酸反应生成 2.24 L H2, 转移电子数为0.3NA
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】实验室为探究铁与浓硫酸![]() 足量
足量![]() 的反应,并验证
的反应,并验证![]() 的性质,设计如图所示装置进行实验,下列说法不正确的是()
的性质,设计如图所示装置进行实验,下列说法不正确的是()
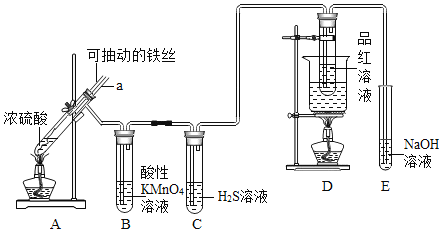
A.装置B中酸性![]() 溶液逐渐褪色,体现了二氧化硫的还原性
溶液逐渐褪色,体现了二氧化硫的还原性
B.实验结束后可向装置A的溶液中滴加KSCN溶液以检验生成的![]()
C.装置D中品红溶液褪色可以验证![]() 的漂白性
的漂白性
D.实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 乙烯通过聚合反应可得到高分子材料
B. 聚丙烯的结构单元是—CH2-CH2-CH2—
C. 碳纤维属于合成有机高分子化合物
D. 聚乙烯塑料的老化是因为发生了加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在耐高温合金工业、催化剂制造、高能燃料等方面有广泛应用。
(1)硼原子的价电子排布图为____________。
(2)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅制造。由第二周期元素组成的与BCl3互为等电子体的阴离子为________。
(3)氮硼烷化合物(H2N→BH2)和Ti(BH4)3均为广受关注的新型储氢材料。
①B与N的第一电离能:B__________N(填“>”“<”或“=”,下同)。H2N―→BH2中B原子的杂化类型为________。
②Ti(BH4)3由TiCl3和LiBH4反应制得。BH4-的立体构型是________;写出制备反应的化学方程式:____________。
(4)磷化硼(BP)是受到高度关注的耐磨材料,它可用作金属表面的保护层。如图为磷化硼晶胞。
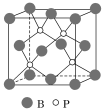
①磷化硼晶体属于______________晶体(填晶体类型),____________(填“是”或“否”)含有配位键。
②晶体中P原子的配位数为____________。
③已知BP的晶胞边长为a nm,NA为阿伏加德罗常数的数值,则磷化硼晶体的密度为____________g·cm-3(用含a、NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠( Na2CO4)是一种很好的供氧剂,其与稀盐酸反应的化学方程式为:2Na2CO4+4HCl=4NaCl+2CO2 +O2+2H2O.市售过碳酸钠一般都含有碳酸钠,为测定某过碳酸钠样品(只含Na2CO4和Na2CO3)的纯度,某化学兴趣小组采用以下两种方案实施:
方案一:![]()
(1)操作①和③的名称分别为
(2)上述操作中,使用到玻璃棒的有 __(填操作序号)。
(3)请简述操作③的操作过程
方案二:按下图安装好实验装置,Q为一塑料气袋,随意取适量样品于其中,打开分液漏斗活塞,将稀盐酸滴入气袋中至充分反应。

(4)为测定反应生成气体的总体积,滴稀盐酸前必须关闭 ,打开 (填“K1”、“K2”或“K3”)。导管a的作用是 。
(5)当上述反应停止后,使K1、K3处于关闭状态,K2处于打开状态,再缓缓打开Kl。 B中装的固体试剂是 ,为何要缓缓打开K1? 。
(6)实验结束时,量筒I中有xmL水,量筒Ⅱ中收集到了ymL气体,则样品中过碳酸钠的质量分数是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是( )
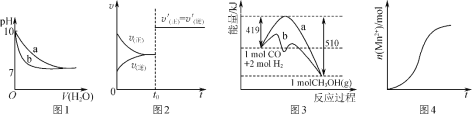
A.图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH变化曲线,其中a表示氨水稀释时pH的变化曲线
B.图2表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂
C.图3表示工业上用CO生产甲醇的反应CO(g)+2H2(g)![]() CH3OH(g),该反应的ΔH=-91 kJ·mol-1
CH3OH(g),该反应的ΔH=-91 kJ·mol-1
D.图4表示10 mL 0.01 mol·L-1酸性KMnO4溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A. 0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)
B. pH=11的氨水和pH=3的盐酸溶液等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C. 在0.1 mol·L-1 Na2CO3溶液中:2c(Na+)=c(CO![]() )+c(HCO
)+c(HCO![]() )+c(H2CO3)
)+c(H2CO3)
D. 0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a1、a2分别为A在甲、乙两个恒温容器中建立平衡体系A(g)![]() 2B(g)时的转化率,已知甲容器保持压强不变,乙容器保持容器体积不变。在温度不变的情况下,均增加A的物质的量,下列判断正确的是
2B(g)时的转化率,已知甲容器保持压强不变,乙容器保持容器体积不变。在温度不变的情况下,均增加A的物质的量,下列判断正确的是
A.a1、a2均减小 B.a1减小,a2增大
C.a1不变,a2增大 D.a1不变,a2减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】伏打电堆由几组锌和银的圆板堆积而成,所有的圆板之间夹放着几张盐水泡过的布。如图所示为最初的伏打电堆模型,由八组锌和银串联组成的圆板堆积而成。下列说法正确的是
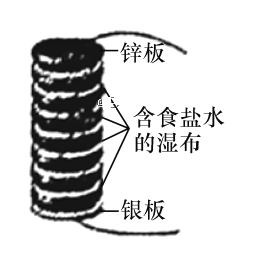
A.该电池发生的反应为析氢腐蚀
B.电池长时间工作后,中间的布上会有白色固体颗粒生成,该固体颗粒为Ag2O
C.当电路中转移0.1 mol电子时,消耗锌板的总质量为26 g
D.该伏打电堆工作时,在银板附近会有Cl2放出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com