
【题目】过碳酸钠( Na2CO4)是一种很好的供氧剂,其与稀盐酸反应的化学方程式为:2Na2CO4+4HCl=4NaCl+2CO2 +O2+2H2O.市售过碳酸钠一般都含有碳酸钠,为测定某过碳酸钠样品(只含Na2CO4和Na2CO3)的纯度,某化学兴趣小组采用以下两种方案实施:
方案一:![]()
(1)操作①和③的名称分别为
(2)上述操作中,使用到玻璃棒的有 __(填操作序号)。
(3)请简述操作③的操作过程
方案二:按下图安装好实验装置,Q为一塑料气袋,随意取适量样品于其中,打开分液漏斗活塞,将稀盐酸滴入气袋中至充分反应。

(4)为测定反应生成气体的总体积,滴稀盐酸前必须关闭 ,打开 (填“K1”、“K2”或“K3”)。导管a的作用是 。
(5)当上述反应停止后,使K1、K3处于关闭状态,K2处于打开状态,再缓缓打开Kl。 B中装的固体试剂是 ,为何要缓缓打开K1? 。
(6)实验结束时,量筒I中有xmL水,量筒Ⅱ中收集到了ymL气体,则样品中过碳酸钠的质量分数是 。
【答案】(1)称量;蒸发结晶;(2)②③;(3)得到的溶液在蒸发皿中加热蒸发,用玻璃棒不断搅拌到大量晶体析出,停止加热靠余热蒸发剩余的水分得到氯化钠固体;(4)K1、K2;K3; 平衡分液漏斗上下的压强使顺利流下;(5)碱石灰;让生成的二氧化碳能充分被b中碱石灰吸收,使量筒内收集到纯净的氧气;(6)![]() 。
。
【解析】试题分析:样品称量可以得到样品质量为m1g,加入稀盐酸溶解后,过滤得到溶液为氯化钠溶液,蒸发浓缩结、冷却结晶、洗涤、干燥得到氯化钠,称量得到固体氯化钠的质量为m2g.
(1)操作①为称量固体质量,操作③为结晶得到氯化钠固体,故答案为:称量;蒸发结晶;
(2)固体溶解需要玻璃棒搅拌加速溶解,溶液中得到溶质固体需要在蒸发皿中加热蒸发结晶,过程中需要玻璃棒搅拌,受热均匀,上述操作中,使用到玻璃棒的有②③,故答案为:②③;
(3)溶液中得到溶质固体的方法是加热蒸发结晶析出,具体操作为:得到的溶液在蒸发皿中加热蒸发,用玻璃棒不断搅拌到大量晶体析出,停止加热靠余热蒸发剩余的水分得到氯化钠固体,故答案为:得到的溶液在蒸发皿中加热蒸发,用玻璃棒不断搅拌到大量晶体析出,停止加热靠余热蒸发剩余的水分得到氯化钠固体;
(4)反应产生的CO2、O2使气球变大,将广口瓶中气体排出,水进入量筒Ⅰ中,所以量筒Ⅰ中水的体积即为产生的CO2、O2的体积,所以滴稀H2SO4前必须关闭K1、K2打开K3,为使分液漏斗内液体顺利流下,应是分液漏斗内外压强相等,所以导管a的作用是平衡分液漏斗上下的压强使顺利流下,故答案为:K1、K2;K3; 平衡分液漏斗上下的压强使顺利流下;
(5)用碱石灰吸收二氧化碳,量筒Ⅱ中排出液态的体积为氧气体积,缓缓打开K1,让生成的二氧化碳能充分被b中碱石灰吸收,使量筒内收集到纯净的氧气,故答案为:碱石灰;让生成的二氧化碳能充分被b中碱石灰吸收,使量筒内收集到纯净的氧气;
(6)量筒I中有xmL水,则CO2、O2的总体积为xmL,量筒Ⅱ中收集到了ymL气体,则O2总体积为y mL,则反应2Na2CO4+4HCl═4NaCl+2CO2+O2+2H2O,生成的二氧化碳为2y mL,碳酸钠反应生成二氧化碳为(x-y-2y)="(x-3y)" mL,生成二氧化碳物质的量之比为2y:(x-3y),则Na2CO4与碳酸钠的物质的量之比为2y:(x-3y),故样品中过碳酸钠的质量分数是![]() =
=![]() ,故答案为:
,故答案为: ![]() 。
。


科目:高中化学 来源: 题型:
【题目】缬氨霉素是一种脂溶性的抗生素,由12个分子组成的环状化合物,它结构如下图所示,有关说法正确的是( )
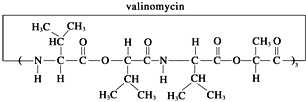
A.缬氨霉素是蛋白质
B.缬氨霉素完全水解可得到四种氨基酸
C.缬氨霉素完全水解后的产物中有两种产物互为同系物
D.缬氨霉素完全水解,其中一种产物与甘油醛[HOCH2CH(OH)CHO]互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品加工中常用焦亚硫酸钠(Na2S2O5)作漂白剂、防腐剂和疏松剂。现实验室欲制备焦亚硫酸钠,其反应依次为:(ⅰ)2NaOH+SO2=Na2SO3+H2O;
(ⅱ)Na2SO3+H2O+SO2=2NaHSO3;
(ⅲ)2NaHSO3![]() Na2S2O5+H2O。
Na2S2O5+H2O。
查阅资料:焦亚硫酸钠为黄色结晶粉末,150℃时开始分解,在水溶液或含有结晶水时更易被空气氧化。
实验装置如下:

(1)实验室可用废铝丝与NaOH溶液制取H2,其离子方程式为___。
(2)通氢气一段时间后,以恒定速率通入SO2,开始的一段时间溶液温度迅速升高,随后温度缓慢变化,溶液开始逐渐变黄。“温度迅速升高”的原因为__。实验后期须利用水浴使温度保持在约80℃。
(3)反应后的体系中有少量白色亚硫酸钠析出,除去其中亚硫酸钠固体的方法是___;然后获得较纯的无水Na2S2O5,应将溶液冷却到30℃左右过滤,控制“30℃左右”的理由是___。
(4)丙为真空干燥Na2S2O5晶体的装置,通入H2的目的是___。
(5)常用剩余碘量法测定产品中焦亚硫酸钠的质量分数。已知:S2O52-+2I2+3H2O=2SO42-+4I-+6H+;2S2O32-+I2=S4O62-+2I-。请补充实验步骤(可提供的试剂有:焦亚硫酸钠样品、标准碘溶液、淀粉溶液、酚酞溶液、标准Na2S2O3溶液及蒸馏水)。
①精确称取产品0.2000g放入碘量瓶(带磨口塞的锥形瓶)中。
②准确移取一定体积的已知浓度的标准碘溶液(过量)并记录数据,在暗处放置5min,然后加入5mL冰醋酸及适量的蒸馏水。
③用标准Na2S2O3溶液滴定至接近终点。
④___。
⑤重复步骤①~③;根据相关记录数据计算出平均值。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)单质铜及镍都是由________键形成的晶体;元素铜与镍的第二电离能分别为:ICu=1958 kJ/mol、INi=1753 kJ/mol,ICu>INi的原因是_____________________。
(2)某镍白铜合金的立方晶胞结构如图所示。
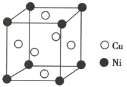
①晶胞中铜原子与镍原子的数量比为________。
②合金的密度为d g/cm3,晶胞参数a=________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X、Y、M(已知M为乙酸)的转化关系为:淀粉→X→Y![]() 乙酸乙酯,下列说法错误的是
乙酸乙酯,下列说法错误的是
A.X可用新制的氢氧化铜悬浊液检验
B.实验室由Y和M制取乙酸乙酯时可用饱和NaOH溶液来提纯
C.由Y生成乙酸乙酯的反应属于取代反应
D.可用碘水检验淀粉是否水解完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.1 L0.1 mol·L-1的氨水中含有的NH3 分子数为 0.1 NA
B.标准状况下, 2.24 L 的 CCl4 中含有的 C-Cl 键数为 0.4 NA
C.14 g 由乙烯与环丙烧 ( C3H6) 组成的混合气体含有的碳原子数目为NA
D.常温常压下, Fe 与足量稀盐酸反应生成 2.24 L H2, 转移电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若在一定条件下,容积恒定的反应室中充入amolCO与2amolH2,在催化剂作用下发生反应CO(g)+2H2(g)![]() CH3OH(g),下列措施一定使
CH3OH(g),下列措施一定使![]() 增大的是( )
增大的是( )
A.升高温度B.充入Ar(g)使体系的总压增大
C.恒温恒容再充入H2D.恒温恒容再充入amolCO和2amolH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是()
A.水电离的c(H+)=1×10-13mol/L 的溶液中:K+、Na+、![]() 、
、![]()
B.1.0mol/L的CH3COOH溶液:K+、Fe3+、![]() 、Cl-
、Cl-
C.在c(OH-):c(H+)=1×1012的溶液: ![]() 、Ca2+、Cl-、K+
、Ca2+、Cl-、K+
D.滴入酚酞试剂不变色的溶液:Na+、![]() 、
、![]() 、
、![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com