
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
| 4 | ⑩ |
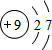 .元素⑩名称为溴.
.元素⑩名称为溴.分析 由元素在周期表的位置可知,①为C,②为N,③为O,④为F,⑤为Ne,⑥为Na,⑦为Al,⑧为S,⑨为Cl,⑩为Br,
(1)原子结构中最外层为8电子的为稳定结构;周期表中F的非金属性最强,原子结构中有2个电子层,最外层电子数为7;⑩为Br元素;
(2)Cl的最高价氧化物对应的水化物中酸性最强;
(3)⑦的单质能与NaOH溶液反应,生成偏铝酸钠和氢气;
(4)最高价氧化物对应的水化物能与其气态氢化物化合生成盐,盐为硝酸铵;
(5)⑥⑦⑧⑨四种元素同周期,阴离子半径大于阳离子半径,具有相同电子排布的阳离子,原子序数大的离子半径小;
(6)利用气态氢化物的稳定性、最高价氧化物对应的水化物酸性、与氢气化合的难易程度、置换反应等比较非金属性.
解答 解:由元素在周期表的位置可知,①为C,②为N,③为O,④为F,⑤为Ne,⑥为Na,⑦为Al,⑧为S,⑨为Cl,⑩为Br,
(1)上述元素中,只有Ne的原子结构中最外层为8电子,化学性质最不活泼;周期表中F的非金属性最强,原子结构中有2个电子层,最外层电子数为7,原子结构示意图为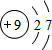 ;⑩为Br元素,名称为溴,故答案为:Ne;F;
;⑩为Br元素,名称为溴,故答案为:Ne;F;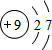 ;溴;
;溴;
(2)Cl的最高价氧化物对应的水化物中酸性最强,水化物为HClO4,故答案为:HClO4;
(3)⑦的单质能与NaOH溶液反应,生成偏铝酸钠和氢气,离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)最高价氧化物对应的水化物能与其气态氢化物化合生成盐,盐为硝酸铵,该元素为N,故答案为:②;
(5)⑥⑦⑧⑨四种元素同周期,阴离子半径大于阳离子半径,具有相同电子排布的阳离子,原子序数大的离子半径小,Al的原子序数大于Na,则离子半径最小的是Al3+,故答案为:Al3+;
(6)a.氢化物的沸点:⑨>⑧,与非金属性无关,故错误;
b.⑨的单质与氢气化合比⑧的单质容易,则非金属性Cl>S,故正确;
c.⑨的单质可置换出⑧的单质,则Cl易得到电子,非金属性Cl>S,故正确;
d.⑨的氢化物的酸性比⑧的氢化物的酸性强,不能比较非金属性,比较角度错误,故错误;
故答案为:bc.
点评 本题考查位置、结构与性质,涉及元素周期表及元素周期律,为高频考点,把握元素的位置、性质及元素周期律为解答的关键,侧重元素性质及元素化合物性质的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NaH2PO4水溶液呈酸性,其溶液中:c(Na+)>c(H2PO4-)>c(H3PO4)>c(HPO42-) | |
| B. | O.1 mol•L-1的CH3COONa溶液与0.1 mol•L-1的CH3COOH溶液等体积混合(PH<7):c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+) | |
| C. | O.1 mol•L-1的(NH4)2SO4溶液与O.1 mol•L-1的NH3•H2O溶液等体积混合:c(NH4+)+c(H+)=2c(SO42-)+c(OH-) | |
| D. | O.1 mol•L-1的Na2CO3溶液与O.2 mol•L-1的NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
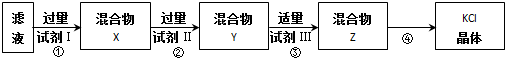
| A. | 起始滤液常温下pH=7 | B. | 试剂Ⅰ为 Ba(NO3)2溶液 | ||
| C. | 上图过程须经2次过滤 | D. | 步骤③目的是除去 CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
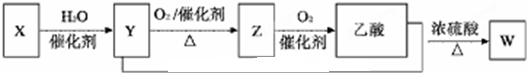
| A. | X能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色,其褪色原理相同 | |
| B. | Y与乙酸反应生成W的反应类型是取代反应 | |
| C. | Z和Y分子中官能团不同 | |
| D. | W的分子式为C4H8O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青铜、不锈钢和硬铝都是合金 | |
| B. | 铝是活泼金属,但在空气中耐腐蚀 | |
| C. | MgO可以与Al组成铝热剂,进行铝热反应 | |
| D. | 铜锈的主要成分是Cu2(OH)2CO3,可以用稀盐酸除铜锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
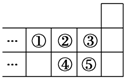
| A. | 元素①位于第二周期第ⅣA族 | B. | 气态氢化物的稳定性:⑤>③ | ||
| C. | 元素的最高正化合价:④=② | D. | 最高价氧化物对应水化物酸性:⑤>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中n(KCl)=n(KClO)+5n(KClO3) | |
| B. | 参加反应的氯气的物质的量一定为0.15mol | |
| C. | 若反应中转移电子为nmol,则0.15mol<n<0.25mol | |
| D. | 共存体系溶液中,n(K+)、n(Cl-)可能为7:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com