
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:选择题
下列说法可以证明可逆反应N2+3H2 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
①一个N≡N键断裂的 同时,有6个N-H键断裂
同时,有6个N-H键断裂
②v(H2)=0.6 mol·L-1·min-1,v(NH3)=0.4 mol·L-1·min-1
③保持其他条件不变时,体系压强不再改变
④NH3、N2、H2的体积分数都不再改变
⑤恒温恒容时,混合气体质量保持不变
A. ②③④ B. ①③④ C. ①②④ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三第二次质检化学试卷(解析版) 题型:选择题
下列热化学方程式书写正确的
A. 甲烷的燃烧热为-890 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+ 2H2O(g)△H=-890 kJ/mol
B. 在一定条件下将1 molSO2和0.5molO2置于密闭容器中充分反应,放出热量79.2kJ,则反应的热化学方程式为:2SO2(g)+O2(g) 2SO3(g) △H=-158.4kJ·mol-1
2SO3(g) △H=-158.4kJ·mol-1
C. NaOH(s)+1/2H2SO4(浓)=1/2Na2SO4(aq)+H2O(l) △H=-57.3kJ·mol-1
D. 2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2589.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016~2017学年江苏省宿迁市高二学业水平测试模拟(二)化学试卷(解析版) 题型:选择题
为确认碳酸氢钠固体中是否含有碳酸钠,下列实验操作及判断正确的是
A. 加热,观察是否放出气体
B. 滴加盐酸,观察是否放出气体
C. 溶于水中,滴加澄清石灰水,观察是否有白色沉淀生成
D. 溶于水中,滴加少量氯化钡溶液,观察是否有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源:2016~2017学年江苏省宿迁市高二学业水平测试模拟(二)化学试卷(解析版) 题型:选择题
工业上生产氮化硅陶瓷反应为3SiCl4+2N2+6H2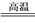 Si3N4+12HCl,有关该反应说法正确的是
Si3N4+12HCl,有关该反应说法正确的是
A. SiCl4是氧化剂 B. N2失电子 C. H2被还原 D. N2发生还原反应
查看答案和解析>>
科目:高中化学 来源:2016~2017学年江苏省宿迁市高二学业水平测试模拟(二)化学试卷(解析版) 题型:选择题
下列物质的名称或俗名与化学式相对应的
A. 小苏打——Na2CO3 B. 火碱——Na2O2
C. 磁性氧化铁——Fe2O3 D. 醋酸——CH3COOH
查看答案和解析>>
科目:高中化学 来源:2017届湖北省七市(州)高三第一次联合调考(3月联考)理科综合化学试卷(解析版) 题型:实验题
从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是______(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):
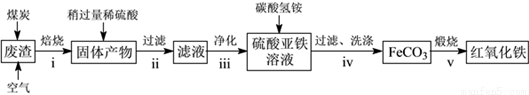
回答下列问题:
①在步骤i中产生的有毒气体可能有__________________。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上将Al3+沉淀完全,则溶液的pH为____________。
③步骤iv中,生成FeCO3的离子方程式是_________________。
(3)氯化铁溶液称为化学试剂中的“多面手”,向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式_________________。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释:___________________。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ii的离子方程式是________________。
②如今基于普鲁士蓝合成原理可检测食品中CN-,方案如下:

若试纸变蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用:
_____________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省湛江市高二上学期期末调研考试化学试卷(解析版) 题型:选择题
甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成.电池的总反应式为2CH3OH+3O2+4OH-═2CO32-+6H2O.则下列说法正确的是
A. 电池放电时通入空气的电极为负极
B. 由于CO32-水解显碱性,电池放电时,电解质溶液的pH逐渐增大
C. 电池放电时负极的电极反应式为CH3OH+8OH--6e-═CO32-+6H2O
D. 电池放电时每消耗1 mol CH3OH转移8 mol电子
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省张家口市高二上学期期末考试化学试卷(解析版) 题型:简答题
Ⅰ.室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略混合后溶液的体积变化),实验数据如下表:
实验序号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
请回答:
(1)HA溶液和KOH溶液反应的离子方程式为________。
(2)实验①反应后的溶液中由水电离出的c(OH-)=________mol·L-1;x________0.2mol·L-1(填“>”“<”或“=”)。
(3)下列关于实验②反应后的溶液说法不正确的是________(填字母)。
a.溶液中只存在着两个平衡
b.溶液中:c(A-)+c(HA)>0.1mol·L-1
c.溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
Ⅱ.已知2H2(g)+O2(g)=2H2O(1) ΔH=-572kJ·mol-1。某氢氧燃料电池以疏松多孔石墨棒为电极,KOH溶液为电解质溶液。
(4)写出该电池工作时负极的电极反应式________。
(5)若该氢氧燃料电池每释放228.8kJ电能时,会生成1mol液态水,则该电池的能量转化率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com