
下列热化学方程式书写正确的
A. 甲烷的燃烧热为-890 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+ 2H2O(g)△H=-890 kJ/mol
B. 在一定条件下将1 molSO2和0.5molO2置于密闭容器中充分反应,放出热量79.2kJ,则反应的热化学方程式为:2SO2(g)+O2(g) 2SO3(g) △H=-158.4kJ·mol-1
2SO3(g) △H=-158.4kJ·mol-1
C. NaOH(s)+1/2H2SO4(浓)=1/2Na2SO4(aq)+H2O(l) △H=-57.3kJ·mol-1
D. 2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2589.6kJ·mol-1
科目:高中化学 来源:2016-2017学年湖南省高一下学期第一次模块考试化学试卷(解析版) 题型:选择题
下列溶液中c(Cl-)与50 mL 1 mol/L AlCl3溶液中c(Cl-)相等的是( )
A. 150 mL 1 mol/L的NaCl溶液 B. 75 mL 2 mol/L的NH4Cl溶液 C. 150 mL 2 mol/L的KCl溶液 D. 75 mL 1 mol/L的FeCl3溶液
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三适应性月考(五)理综化学试卷(解析版) 题型:填空题
甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为CO(g)+2H2(g) CH3OH(g) △H。
CH3OH(g) △H。
(1)在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间的变化如下图甲所示。
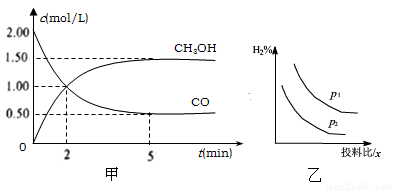
①从反应开始到5min,用氢气表示的平均反应速率v(H2)=________。
②下列说法正确的是________(填序号)。
A. 达到平衡时,H2的转化率为75%
B. 5min后容器中压强不再改变
C. 达到平衡后,再充入氩气,反应速率增大
D. 2min前v(正)>v(逆),2min后v(正)<v(逆)
(2)某温度下,在一恒压容器中分别充入1.2molCO和1molH2,达到平衡时容器体积为2L,且含有0.4molCH3OH(g),则该反应平衡常数的值为_______,此时向容器中再通入0.35molCO气体,则此平衡将___(填“正向移动”“不移动”或“逆向移动”)
(3)若压强、投料比x [n(CO)/n(H2)]对反应的影响如图乙所示,则图中曲线所示的压强关系:p1___p2(填“=”“>”或“<”),其判断理由是__________。
(4)甲醇是一种新型的汽车动力燃料。已知H2(g)、CO(g)、CH3OH(l)的燃烧热分别为285.8kJ/mol、283.0kJ/mol和726.5kJ/mol,则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____。
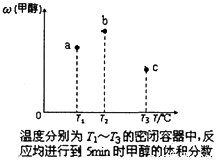
(5)现有容积均为1L的a、b、c三个密闭容器,往其中分别充入1molCO和2molH2的混合气体,控制温度,进行反应,测得相关数据的关系如下图所示。b中甲醇体积分数大于a中的原因是_____。达到平衡时,a、b、c中CO的转化率大小关系为___________。
(6)甲醇作为一种燃料还可用于燃料电池。在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。该电池的负极反应式为____。
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三3月高考适应性测试理综化学试卷(解析版) 题型:选择题
常温下,用0.10mol/LNaOH溶液滴定20.00 mL稀醋酸(HAc),下列说法中正确的是
A. 当混合溶液的pH>7时,其中不可能存在HAc分子
B. 当混合溶液的pH<7时,混合液中c(Na+)>c((Ac-)
C. 判断该滴定过程的终点,最好选择甲基橙作为指示剂
D. 达到滴定终点时,混合液中c(Na+)和c((Ac-)一定不相等
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三第二次质检化学试卷(解析版) 题型:简答题
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3•CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中.从废料中回收氧化钴(CoO)的工艺流程如下:
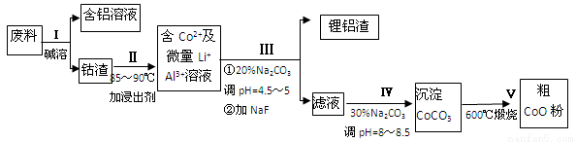
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 .
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴.则浸出钴的离子反应方程式为 (产物中只有一种酸根).请从反应原理分析不用盐酸浸出钴的主要原因 .
(3)碳酸钠溶液在过程III和IV中所起作用有所不同,请分别用离子方程式表示在过程III、IV中起的作用: .
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三第二次质检化学试卷(解析版) 题型:选择题
根据如图的转化关系判断下列说法正确的是(反应条件已略去)
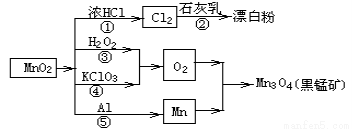
A. 反应①②③④⑤均属于氧化反应和离子反应
B. 反应⑤说明该条件下铝的还原性强于锰
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1
D. 反应①中氧化剂与还原剂的物质的量之比为1:4
查看答案和解析>>
科目:高中化学 来源:2016~2017学年江苏省宿迁市高二学业水平测试模拟(二)化学试卷(解析版) 题型:简答题
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖的漂白和杀菌,其一种生产工艺流程如下:

回答下列问题:
(1) 写出“反应”步骤中生成ClO2的化学方程式:________________________。
(2) “电解”所用食盐水由粗盐水精制而成,精制时为除去Mg2+和Ca2+,要加入的试剂分别为___________________、___________________。

(3) 亚氯酸钠(NaClO2)在水溶液中可生成ClO2、HClO2、ClO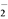 、Cl-等,其中HClO2和ClO2都具有漂白作用。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则使用该漂白剂的适宜pH________(填“大于”“ 等于”或“小于”)3。
、Cl-等,其中HClO2和ClO2都具有漂白作用。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则使用该漂白剂的适宜pH________(填“大于”“ 等于”或“小于”)3。
(4) 为了测定NaClO2·3H2O的纯度,取上述合成产品10.00 g溶于水配成1000 mL溶液,取出20.00 mL溶液于锥形瓶中,再加入足量硫酸酸化的KI溶液,充分反应后加入2~3滴淀粉溶液,用0.2640 mol·L-1Na2S2O3标准溶液滴定,共用去Na2S2O3标准溶液20.00 mL,通过计算确定该产品纯度是否合格?(合格纯度在90%以上)(写出计算过程)__________
提示: 2Na2S2O3+I2===Na2S4O6+2NaI。
查看答案和解析>>
科目:高中化学 来源:2016~2017学年江苏省宿迁市高二学业水平测试模拟(二)化学试卷(解析版) 题型:选择题
下列有机物属于高分子化合物的是
A. 淀粉 B. 脂肪 C. 乙酸乙酯 D. 蔗糖
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省湛江市高二上学期期末调研考试化学试卷(解析版) 题型:选择题
已知化学反应A2(g)+B2(g)=2AB(s)的能量变化如图所示,下列叙述正确的是
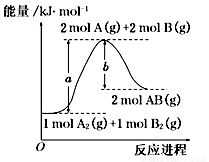
A. 该反应为放热反应
B. A—B的键能为bkJ•mol-1
C. 加催化剂能降低该反应焓变
D. 该反应的反应热为△H=(a-b)kJ•mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com