
【题目】如图装置中,观察到:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面。以下有关解释合理的是( )
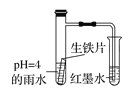
A.生铁片中的碳是原电池的负极,发生还原反应
B.雨水酸性较强,生铁片仅发生析氢腐蚀
C.具支试管中溶液pH逐渐减小
D.墨水回升时,碳极反应式为O2+2H2O+4e–=4OH–
【答案】D
【解析】
正常雨水的pH是5.6,溶液呈酸性,生铁中含有碳和铁,酸性条件下,生铁发生析氢腐蚀生成氢气,导致具支试管内气体压强大于大气压,导管内液面下降,当溶液呈弱酸性或中性时,生铁发生吸氧腐蚀,导致具支试管中气体压强小于大气压,导管内液面回升,略高于小试管液面。
A.铁、碳和电解质溶液构成原电池,碳作正极,正极上得电子发生还原反应,故A错误;
B.通过以上分析知,生铁片发生析氢腐蚀和吸氧腐蚀,故B错误;
C.具支试管中溶液,先呈酸性,发生析氢腐蚀时,溶液酸性逐渐减弱pH增大,当发生吸氧腐蚀时,负极上铁失电子生成亚铁离子,正极上生成氢氧根离子,亚铁离子和氢氧根离子生成氢氧化铁沉淀,溶液的pH不变,所以反应过程中,溶液的pH先增大达到一定值后不变,故C错误;
D.墨水回升时,生铁片发生吸氧腐蚀,碳极上氧气得电子生成氢氧根离子,电极反应式为:O2+2H2O+4e-=4OH-,故D正确;
故选D。


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。回答下列问题:
(1)Ca小于Ti的是_______(填标号)。
A.最外层电子数 B.未成对电子数 C.原子半径 D.第三电离能
(2)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
① Cl2O2的沸点比H2O2低,原因是___________________________________。
② O3分子中心原子杂化类型为_______;O3是极性分子,理由是___________________。
(3)Na3OCl可由以下两种方法制得:
方法Ⅰ Na2O + NaCl![]() Na3OCl
Na3OCl
方法II 2Na + 2NaOH + 2NaCl![]() 2Na3OCl + H2↑
2Na3OCl + H2↑
① Na2O的电子式为____________。
② 在方法Ⅱ的反应中,形成的化学键有_______(填标号)。
A.金属键 B.离子键 C.配位键 D.极性键 E.非极性键
(4)Na3OCl晶体属于立方晶系,其晶胞结构如右所示。已知:晶胞参数为a nm,密度为d g·cm-3。
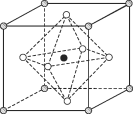
①Na3OCl晶胞中,Cl位于各顶点位置,Na位于_________位置,两个Na之间的最短距离为________nm。
②用a、d表示阿伏加德罗常数的值NA=__________________(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己烯是重要的化工原料。其实验室制备流程如下:
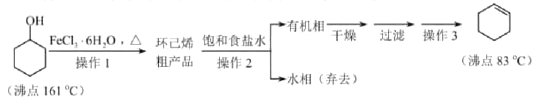
回答下列问题:
Ⅰ.环己烯的制备与提纯
(1)原料环己醇中若含苯酚杂质,检验试剂为____________,现象为__________________。
(2)操作1的装置如图所示(加热和夹持装置已略去)。
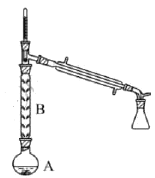
①烧瓶A中进行的可逆反应化学方程式为________________________,浓硫酸也可作该反应的催化剂,选择![]() 而不用浓硫酸的原因为________________________(填序号)。
而不用浓硫酸的原因为________________________(填序号)。
a.浓硫酸易使原料碳化并产生![]()
b.![]() 污染小、可循环使用,符合绿色化学理念
污染小、可循环使用,符合绿色化学理念
c.同等条件下,用![]() 比浓硫酸的平衡转化率高
比浓硫酸的平衡转化率高
②仪器B的作用为____________。
(3)操作2用到的玻璃仪器是____________。
(4)将操作3(蒸馏)的步骤补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,____________,弃去前馏分,收集83℃的馏分。
Ⅱ.环己烯含量的测定
在一定条件下,向![]() 环己烯样品中加入定量制得的
环己烯样品中加入定量制得的![]() ,与环己烯充分反应后,剩余的
,与环己烯充分反应后,剩余的![]() 与足量
与足量![]() 作用生成
作用生成![]() ,用
,用![]() 的
的![]() 标准溶液滴定,终点时消耗
标准溶液滴定,终点时消耗![]() 标准溶液
标准溶液![]() (以上数据均已扣除干扰因素)。
(以上数据均已扣除干扰因素)。
测定过程中,发生的反应如下:
①![]()
②![]()
③![]()
(5)滴定所用指示剂为____________。样品中环己烯的质量分数为____________(用字母表示)。
(6)下列情况会导致测定结果偏低的是____________(填序号)。
a.样品中含有苯酚杂质
b.在测定过程中部分环己烯挥发
c.![]() 标准溶液部分被氧化
标准溶液部分被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的事实是
A. 红棕色的NO2加压后颜色先变深后变浅
B. 氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C. 黄绿色的氯水光照后颜色变浅
D. 合成氨工业使用高压以提高氨的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究Mg(OH)2溶于铵盐溶液的原因,进行如下实验:
①向2mL 0.2mol/LMgCl2溶液中滴加1mol/LNaOH溶液至不再产生沉淀,将浊液分为2等份。
②向一份中逐滴加入4mol/L NH4Cl溶液,另一份中逐滴加入4mol/L CH3COONH4溶液(pH≈7),边滴加边测定其中沉淀的量,沉淀的量与铵盐溶液的体积的关系如图。
③将①中的NaOH溶液用氨水替换,重复上述实验。
下列说法不正确的是
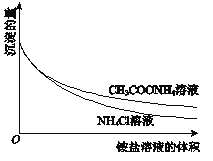
A. Mg(OH)2浊液中存在:Mg(OH)2(s)![]() Mg2+(aq)+2OH﹣(aq)
Mg2+(aq)+2OH﹣(aq)
B. ②中两组实验中均存在反应:Mg(OH)2+2NH4+=Mg2++2NH3H2O
C. H+可能参与了NH4Cl溶液溶解Mg(OH)2的过程
D. ③中获得的图象与②相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某冶炼厂利用含ZnO的烟灰脱除工业废气中的SO2,最终得到锌盐。该厂所用烟灰的主要成分如下表所示:
主要成分 | ZnO | CaO | Fe2O3 | SiO2 | 其它 |
质量分数/% | 81 | 0.098 | 1.14 | 0.5 | ———— |
在一定条件下,将含SO2的工业废气通入烟灰浆液(烟灰和水的混合物)进行脱硫,过程中测得pH和上清液中溶解的SO2物质的量浓度[c(SO2)]随时间的变化如图所示:

(1)纯ZnO浆液的pH为6.8,但上述烟灰浆液的初始pH为7.2。在开始脱硫后3 min内(a~b段),pH迅速降至6.8,引起pH迅速变化的原因是_____(结合化学用语解释)。
(2)生产中脱除SO2效果最佳的时间范围是_____(填字母序号)。
A.20~30 min B.30~40 min C.50~60 min D.70~80 min
(3)在脱硫过程中涉及到的主要反应原理:
Ⅰ.ZnO + SO2 === ZnSO3↓
Ⅱ.ZnSO3 + SO2 + H2O === Zn(HSO3)2
①在30~40 min时,主要发生反应II,生成可溶性的Zn(HSO3)2。上清液中c(SO2)上升的原因可能是______。
②在30~80 min时,pH降低的原因可能是______(写出2点)。
③将脱硫后的混合物利用空气氧化技术处理,该过程中发生反应:2ZnSO3 + O2 === 2ZnSO4和______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定体积的密闭容器中,向容器内充入2molA和1molB,发生如下反应:2A(g) + B(g)![]() 3C(g) + D(s),反应达到平衡时C的物质的量浓度为1.2 mol/L。若维持容器的温度和体积不变,按下列方法改变起始物质,达到平衡时C的浓度仍为1.2 mol/L的是
3C(g) + D(s),反应达到平衡时C的物质的量浓度为1.2 mol/L。若维持容器的温度和体积不变,按下列方法改变起始物质,达到平衡时C的浓度仍为1.2 mol/L的是
A.4molA + 2molBB.3molC+ 1molD+ 1molB
C.6molC + 0.8molDD.1.6molA+0.8molB + 0.6molC+0.3molD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是____________。
(2)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。
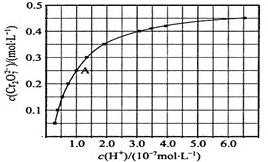
①用离子方程式表示Na2CrO4溶液中的转化反应__________。
②由图可知,溶液酸性增大,CrO42的平衡转化率___________(填“增大“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为___________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH_________0(填“大于”“小于”或“等于”)。
(3)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72还原成Cr3+,反应的离子方程式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com