
分析 (1)①Mg在二氧化碳中燃烧生成MgO和C;
②加热条件下,碳酸氢钠分解生成碳酸钠、二氧化碳和水;
(2)①氢氧化铝属于两性氢氧化物,能和酸反应生成盐和水;
②钠能和水反应生成NaOH和氢气.
解答 解:(1)①Mg在二氧化碳中燃烧生成MgO和C,生成的C具有可燃性,所以不能用液态二氧化碳作镁的灭火剂,反应方程式为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
②加热条件下,碳酸氢钠分解生成碳酸钠、二氧化碳和水,反应方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(2)①氢氧化铝属于两性氢氧化物,能和酸反应生成盐和水,所以氢氧化铝能和盐酸反应生成盐和水,从而降低盐酸浓度,离子反应方程式为Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+=Al3++3H2O;
②钠能和水反应生成NaOH和氢气,氢气具有可燃性,所以不能用水作钠的灭火剂,离子方程式为2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑.
点评 本题以钠、镁、铝的化合物为载体考查离子方程式、化学方程式的书写,为高频考点,明确物质性质及离子方程式书写规则是解本题关键,题目难度不大.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| Al2O3 | Si | Na2O2 | 水泥、玻璃、陶瓷 |
| 两性氧化物 | 单质 | 碱性氧化物 | 无机非金属材料 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
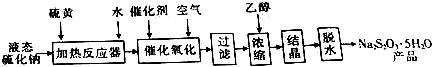
| 溶液温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 氧化完全所需时间/h | 6 | 5.5 | 5.5 | 6 | 20 | 16 | 11 | 11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,KW增大,pH不变 | |
| B. | 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 | |
| C. | 向水中加入少量氯化铵,c(H+)增大 | |
| D. | 向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸与氢氧化钡在溶液中反应Ba2++SO42-═BaSO4↓ | |
| B. | 氢氧化镁溶于稀硫酸:2H++Mg(OH)2═Mg2++2H2O | |
| C. | 大理石与盐酸反应 CO32-+2H+═H2O+CO2↑ | |
| D. | 少量金属钠投入到CuSO4溶液中 2Na+Cu2+═2Na++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{2}^{3}$He原子核内有2个中子 | |
| B. | ${\;}_{2}^{3}$He原子核外有3个电子 | |
| C. | ${\;}_{2}^{3}$He原子核内有3个质子 | |
| D. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He是两种不同的核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、H+、SO32-、ClO- | B. | Na+、Cu2+、Cl-、SO42- | ||
| C. | Pb2+、NH4+、Cl-、CH3CHOO- | D. | K+、Fe3+、NO3-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).| 碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 900 | 1172 | 1360 |
| 阳离子半径/pm | 99 | 112 | 135 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com