
【题目】常温下,有pH=12的NaOH溶液100 mL,若将其pH变为11(溶液混合忽略体积变化;计算结果保留到小数点后一位)。
(1)若用pH=10的NaOH溶液,应加入_________mL。
(2)若用pH=2的盐酸,应加入_________mL。
(3)若用水稀释,则加入水的体积为____________________ mL。
(4)常温下,设pH=5的H2SO4溶液中由水电离出的H+浓度为c1;pH=11的NaOH溶液中由水电离出的H+浓度为c2,则c1/c2=_________。
(5)常温下,pH=11的NaOH溶液aL与pH=5的H2SO4溶液bL混合,若所得混合溶液呈中性,则a∶b=_________。
【答案】100081.89001001:100
【解析】
(1)常温下,pH=12的NaOH溶液中c(OH-)=10-2mol·L-1,pH=10的NaOH溶液中c(OH-)=10-4mol·L-1,根据混合后溶质的物质的量等于混合前溶质物质的量的和,![]() =10-3,解得V=1000mL;(2)反应后溶液显碱性,因此有
=10-3,解得V=1000mL;(2)反应后溶液显碱性,因此有![]() =10-3,解得V≈81.8mL;(3)稀释过程中溶质的物质的量不变,因此有
=10-3,解得V≈81.8mL;(3)稀释过程中溶质的物质的量不变,因此有![]() =10-3,解得V=900mL;(4)pH=5的H2SO4中水电离出的c(H+)=c(OH-)=10-9mol·L-1,pH=11的NaOH溶液中水电离出的c(OH-)=c(H+)=10-11mol·L-1,则c1:c2=10-9:10-11=100:1;(5)溶液显中性,n(OH-)=n(H+)=a×10-3=b×10-5,则a:b=1:100。
=10-3,解得V=900mL;(4)pH=5的H2SO4中水电离出的c(H+)=c(OH-)=10-9mol·L-1,pH=11的NaOH溶液中水电离出的c(OH-)=c(H+)=10-11mol·L-1,则c1:c2=10-9:10-11=100:1;(5)溶液显中性,n(OH-)=n(H+)=a×10-3=b×10-5,则a:b=1:100。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图所示是101 kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是( )
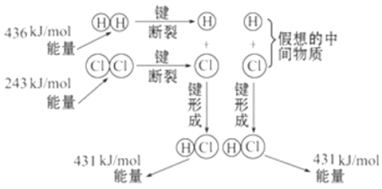
A. 1 mol H2中的化学键断裂时需要吸收436 kJ能量
B. 2 mol HCl分子中的化学键形成时要释放862 kJ能量
C. 此反应的热化学方程式为:H2(g)+Cl2(g)==2HCl(g)ΔH=+183 kJ/mol
D. 此反应的热化学方程式为:1/2H2(g)+1/2Cl2(g)==HCl(g)ΔH=-91.5 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,五种元素核内质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)A2W的电子式为________。
(2)B中质子数和中子数相等的核素符号为____,E元素在周期表中的位置为_______ 。
(3)W、D、E三种元素的简单离子半径由小到大的顺序为_______(填离子符号)。
(4)在一定条件下,D元素的单质能与A元素的单质化合生成DA,DA能与水反应放氢气,则其化学方程式为_______,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是______L(标准状况下)。
(5)若要比较D和E的金属性强弱,下列实验方法可行的是_______。
a.将D单质置于E的盐溶液中,若单质D不能置换出单质E,说明D的金属性弱
b.将少量D、E的单质分别投入到水中,若D反应而E不反应,说明D的金属性强
C.比较相同条件下D和E的最高价氧化物对应水化物的溶解性若前者比后者溶解度大,说明D的金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热△H=-57.3 kJ·mol1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol1
B. 甲烷的标准燃烧热ΔH=-890.3 kJ·mol1,则CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH<-890.3 kJ·mol1
C. 已知:500℃、30MPa下,N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
D. CO(g)的燃烧热是283.0kJ·mol1,则2CO2(g) ===2CO(g)+O2(g)反应的△H=+566.0 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关胶体的说法正确的是
A. 有的胶体是纯净物,有的胶体是混合物
B. 有的胶体带电,有的胶体不带电
C. 工厂中常用的静电除尘装置是根据胶体的某些性质设计的
D. 胶体、溶液和浊液的本质区别是能否产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种香料,存在于金橘中,可用如下路线合成:

回答下列问题:
(1)11.2 L(标准状况)的烃A在氧气中充分燃烧可以产生88g CO2和45gH2O。A的分子式是___________。
(2)D的名称(系统命名)为____________________;
(3)在催化剂存在下1mol F与2 mol H2反应,生成3-苯基-1-丙醇,F的结构简式是_______________;
(4)反应①的反应类型是___________________;
(5)反应②的化学方程式为___________________;
(6)与G具有相同的官能团的芳香类同分异构体有________种(不含G),其中HNMR中有五组峰,峰面积比为1∶1∶2∶2∶2的异构体的结构简式:___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的原子核外M层上有3个电子,元素Y形成的离子Y2-核外有18个电子,则这两种元素可形成化合物( )
A.XY2B.X2Y3C.X3Y2D.X2Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )

选项 | ① | ② | ③ | 实验结论 |
A | 稀盐酸 | CaCO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
B | 浓硫酸 | 蔗糖 | Ba(NO3)2溶液 | 验证SO2与可溶性钡盐可生成白色沉淀 |
C | 浓氨水 | 生石灰 | 酚酞溶液 | 氨气的水溶液呈碱性 |
D | 浓硝酸 | Fe | NaOH溶液 | 铁和浓硝酸反应可生成NO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用废铅蓄电池的铅泥(含PbSO4、PbO和Pb等)制备精细化工产品PbSO4·3PbO·H2O(三盐)的主要流程如下:

已知:常温下,Ksp(PbSO4)=2.0×10-8 Ksp(PbCO3)=1.0×10-13 ,请回答以下问题:
(1)铅蓄电池工作原理是PbO2+Pb+2H2SO4![]() 2PbSO4+2H2O,在放电过程中负极的质量__________;电解质溶液的pH___________(用“变大”、“不变”或“变小”填写)。该铅蓄电池放电过程中的正极反应式为__________________________________________。
2PbSO4+2H2O,在放电过程中负极的质量__________;电解质溶液的pH___________(用“变大”、“不变”或“变小”填写)。该铅蓄电池放电过程中的正极反应式为__________________________________________。
(2)步骤③的目的是使铅泥中的Pb溶解,其对应的离子方程式为________________ 。滤液2中的溶质主要是_____________(填化学式),过滤操作中使用到的玻璃仪器有_____。
(3)步骤⑥合成三盐的化学方程式为________________________。
(4)步骤⑦洗涤产品的方法是________________________________。
(5)在“转化”过程中,若PbSO4和PbCO3在悬浊液中共存,则c(SO42-):c(CO32-)=____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com