
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.18gT2O和18gH2O中含有的质子数均为10NA
B.1L1mol/L的Na2CO3溶液中CO32-和HCO3-离子数之和为NA
C.78gNa2O2与足量CO2充分反应转移的电子数目为2NA
D.加热条件下,含0.2molH2SO4的浓硫酸与足量铜反应,生成SO2的分子数小于0.1NA
【答案】D
【解析】
A.T2O的摩尔质量为22,18gT2O的物质的量为![]() mol,含有的质子数为
mol,含有的质子数为![]() NA,A选项错误;
NA,A选项错误;
B.1mol/L的Na2CO3溶液中,由物料守恒有c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)=2mol/L,则c(CO32-)+c(HCO3-)+c(H2CO3)=1mol/L,c(CO32-)+c(HCO3-)<1mol/L,即离子数之和小于NA,B选项错误;
C.78gNa2O2的物质的量为1mol,与足量CO2充分反应转移电子数应为1NA,C选项错误;
D.随着反应的进行,浓硫酸的浓度降低变成稀硫酸后,不会再与铜发生反应,故加热条件下,含0.2molH2SO4的浓硫酸与足量铜反应,生成SO2的分子数小于0.1NA,D选项正确;
答案选D。


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】下列有关微粒间作用力的说法正确的是
A. 硼酸[B(OH)3]晶体具有与石墨相似的层状结构,则分子中B原子发生的是sp3杂化,不同层分子间主要作用力是范德华力
B. 金属键可以看作是许多原子共用许多电子所形成的强烈的相互作用,所以与共价键类似也有方向性和饱和性
C. 干冰气化和冰融化克服的分子间作用力相同
D. 离子晶体熔融状态电离过程中,只有离子键被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以石油裂解气E为原料,通过下列化学反应制取1,3-丙二醇。
![]()
已知E能使酸性高锰酸钾溶液退色;同温同压下,E的密度是H2的21倍;E分子中有3种不同化学环境的氢原子,其个数比为1∶2∶3。下列关于E的叙述不正确的
A. E的相对分子质量为42
B. E的结构简式为CH2=CHCH3
C. E分子中所有的碳原子在同一平面上
D. 反应①是将E通入溴的四氯化碳溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氧气中充分燃烧0.2 mol某有机物,得到0.4 molCO2和10.8 g H2O,由此可得出的结论是( )
A.该有机物分子中只含有2个碳原子和6个氢原子
B.该有机物中碳元素和氢元素的原子个数比为3∶1
C.该有机物分子中含有2个CO2和3个H2O
D.该有机物分子中含有2个碳原子和6个氢原子,可能含有氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几百年前,著名化学家波义耳发现了铁盐与没食子酸(结构简式为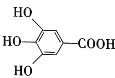 )之间的显色反应,并由此发明了蓝黑墨水。
)之间的显色反应,并由此发明了蓝黑墨水。
(1)没食子酸的分子式为__,所含官能团的名称为__。
(2)用没食子酸制造墨水主要利用了__(填序号)类化合物的性质。
A.醇 B.酚 C.油脂 D.羧酸
(3)下列试剂与没食子酸混合后不能很快反应的是__(填序号)。
A.酸性KMnO4溶液 B.浓溴水 C.乙醇
(4)假设没食子酸的合成途径如下:
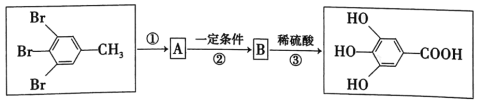
A的结构简式为__,①的反应类型为_;反应②的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机玻璃(聚甲基丙烯酸甲酯)具有透光率高、自重轻、安全性能高等优点,目前它广泛用于制作仪器仪表零件、照明灯罩、光学镜片、透明屋顶、电话亭、广告灯箱、标志牌等。如图是以![]() 甲基丙烯为原料合成有机玻璃E(聚
甲基丙烯为原料合成有机玻璃E(聚![]() 甲基丙烯酸甲酯)的路线:
甲基丙烯酸甲酯)的路线:
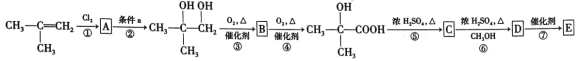
(1)有机化合物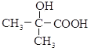 中含有的官能团名称是______________。
中含有的官能团名称是______________。
(2)写出B的结构简式:________________。
(3)写出反应①的化学方程式______________。
(4)写出反应⑥的化学方程式_______________。
(5)在上述①~⑥反应中,属于取代反应的是_______,属于加成反应的是_______。
(6)写出E的结构简式:_______。
(7)写出有机物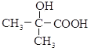 通过缩聚反应形成的高分子聚酯F的结构简式:_________。
通过缩聚反应形成的高分子聚酯F的结构简式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物对环境、生产和人类生命活动等具有很大的影响。请按要求回答下列问题:
(1)利用某分子筛作催化剂,NH3可脱除工厂废气中的NO、NO2,反应机理如图所示。A包含的物质为H2O和___(填化学式)。

(2)研究氮氧化物与悬浮在大气中的海盐粒子的相互作用时,涉及如下反应:
①2NO2(g)+NaCl(g)=NaNO3(g)+ClNO(g) ΔH1<0
②2NO(g)+Cl2(g)=2ClNO(g) ΔH2<0
则4NO2(g)+2NaCl(g)=2NaNO3(g)+2NO(g)+Cl2(g)的ΔH=___(用ΔH1和ΔH2表示)。
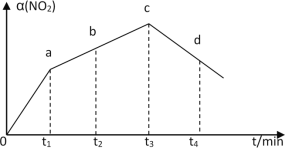
若反应①在绝热密闭容器中进行,实验测得NO2(g)的转化率随时间的变化示意图如图所示,NO2(g)的转化率α(NO2)在t3-t4时间降低的原因是___。
(3)工业上利用氨气生产氢氰酸(HCN)的反应为CH4(g)+NH3(g)![]() HCN(g)+3H2(g) ΔH>0。在一定温度下,向2L密闭容器中加入nmolCH4和2molNH3平衡时NH3体积分数随n变化的关系如图所示。
HCN(g)+3H2(g) ΔH>0。在一定温度下,向2L密闭容器中加入nmolCH4和2molNH3平衡时NH3体积分数随n变化的关系如图所示。

a点时,CH4的转化率为___%;平衡常数:K(a)___K(b)(填“>”“=”或“<”)。
(4)肌肉中的肌红蛋白(Mb)与O2结合生成MbO2,其反应原理可表示为Mb(aq)+O2(g)![]() MbO2(aq),该反应的平衡常数可表示为K=
MbO2(aq),该反应的平衡常数可表示为K=![]() ,在一定条件下达到平衡时,测得肌红蛋白的结合度(α)[α=
,在一定条件下达到平衡时,测得肌红蛋白的结合度(α)[α=![]() ×100%]与p(O2)的关系如图所示。研究表明正反应速率V正=k正·c(Mb)·p(O2),逆反应速率V逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。
×100%]与p(O2)的关系如图所示。研究表明正反应速率V正=k正·c(Mb)·p(O2),逆反应速率V逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。
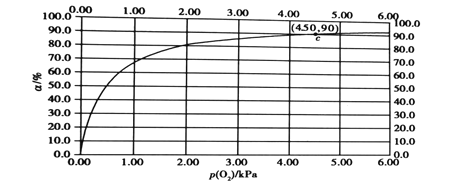
①试写出平衡常数K与速率常数k正、k逆的关系式:K=___(用含有k正、k逆的式子表示)。
②试求出图中c(4.50,90)点时,上述反应的平衡常数K=___kPa-1。已知k逆=60s-1,则速率常数k正=___s·kPa-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇催化氧化制取乙醛(沸点为20.8℃,能与水混溶)的装置(夹持装置已略) 如图所示。下列说法错误的是
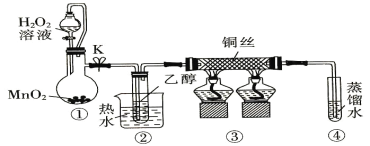
A.①中用胶管连接其作用是平衡气压,便于液体顺利流下
B.实验过程中铜丝会出现红黑交替变化
C.实验开始时需先加热②,再通O2,然后加热③
D.实验结束时需先将④中的导管移出,再停止加热。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pC类似pH,是指稀溶液中溶质物质的量浓度的负对数。如某溶液溶质的浓度为1×10-3mol/L,则该溶液中溶质的pC=3。下列叙述正确的是
A.某温度下,任何电解质的稀溶液中,pC(H+)![]() pC(OH-)
pC(OH-)![]()
B.0.01mol/L的CaCl2溶液中逐滴加入纯碱溶液,滴加过程中pC(Ca2+)逐渐增大
C.0.01mol/L的BaCl2溶液中,pC(Cl-)![]() 2pC(Ba2+)
2pC(Ba2+)
D.用0.01mol/L的盐酸滴定某浓度的NaOH溶液,NaOH溶液的pC(OH-)逐渐减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com