
【题目】HCl和NaOH(待测)中和滴定时计算公式c(NaOH)=______。H2SO4和NaOH(待测)中和滴定时计算公式c(NaOH)=____。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,有浓度均为![]() 的下列四种溶液:
的下列四种溶液:
①![]() 溶液 ②
溶液 ②![]() 溶液 ③
溶液 ③![]() 溶液 ④
溶液 ④![]() 溶液
溶液
(1)这四种溶液pH由大到小的顺序是______,其中由水电离的![]() 浓度最小的是______。(均填序号)
浓度最小的是______。(均填序号)
(2)②中各离子浓度由大到小的顺序是__________,![]() 的水解平衡常数
的水解平衡常数![]() ______
______![]() 。(已知碳酸的电离常数
。(已知碳酸的电离常数![]() )
)
(3)向③中通入少量氨气,此时 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积______④的体积(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向100mL 0.01mol·L-1的NaHA溶液中分别加入浓度均为0.01mol·L-1的NaOH溶液和盐酸,混合溶液的pH随所加溶液体积的变化如图所示(忽略过程中的体积变化)。下列说法不正确的是
A. 25℃时,H2A的第二步电离平衡常数约为10-6
B. 水的电离程度:N>M>P
C. 随着盐酸的不断滴入,最终溶液的pH小于2
D. P点时溶液中存在:2c(H2A)+c(HA-)+c(H+)=c(OH-)+c(Na+)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。下列关于海洋氮循环的说法正确的是
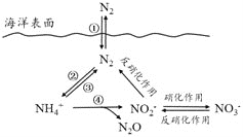
A. 海洋中的氮循环起始于氮的氧化
B. 海洋中的氮循环属于固氮作用的是③
C. 海洋中的反硝化作用一定有氧气的参与
D. 向海洋排放含NO3—的废水会影响海洋中NH4+的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是( )
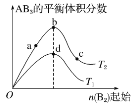
A.在T2和n(A2)不变时达到平衡,AB3的物质的量大小为c>b>a
B.若T2>T1,则正反应一定是放热反应
C.达到平衡时A2的转化率大小为b>a>c
D.若T2>T1,达到平衡时b、d点的反应速率为vd>vb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO是合成尿素、甲酸的原料。
(1)在100 kPa和T K下,由稳定单质生成1 mol化合物的焓变称为该物质在T K时的标准摩尔生成焓,用符号ΔHθ表示。已知石墨和一氧化碳的燃烧热分别为393.5 kJ·mol-1和283.0 kJ·mol-1,则CO(g)的ΔHθ=_________。
(2)合成尿素的反应:2NH3(g)+CO(g)CO(NH2)2(g)+H2(g) ΔH=-81.0 kJ·mol-1;T℃时,在体积为2 L 的恒容密闭容器中,将2 mol的NH3和1 mol CO混合反应,5 min时,NH3的转化率为80%。则0~5 min平均反应速率为v(CO)=_________。
已知:
温度/K | 398 | 498 | … |
平衡常数(K) | 126.5 | K1 | … |
则:K1________(填“>”或“<”)126.5;其判断理由是__________。
(3)若保持恒温恒容条件,将物质的量之和为3 mol的NH3和CO以不同的氨碳比进行反应,结果如图所示:
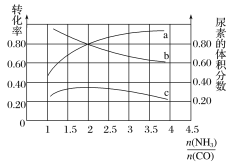
①若图中c表示平衡体系中尿素的体积分数,则a表示________的转化率。
②当![]() =________时,尿素含量最大;在该条件下,对于该反应既能增大反应速率又能使平衡正向移动的措施是_____(写一种)。
=________时,尿素含量最大;在该条件下,对于该反应既能增大反应速率又能使平衡正向移动的措施是_____(写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )

A. MOH的碱性强于ROH的碱性
B. ROH的电离程度:b点大于a点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是

A.Kb2的数量级为10-8
B.X(OH)NO3水溶液显酸性
C.等物质的量的X(NO3)2和X(OH)NO3混合溶液中 c(X2+)>c[X(OH)+]
D.在X(OH)NO3水溶液中,c[X(OH)2]+c(OH-)= c(X2+)+ c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普鲁苯辛用于治疗胃炎、胰腺炎、胆汁排泄障碍、多汗症、孕妇呕吐及遗尿。普鲁苯辛的合成路线如下:

回答下列问题:
(1)有机物A的名称是_____,F中官能团的名称是 ____。
(2)碳原子上连有四个不同的原子或基团时,该碳称为手性碳。普鲁苯辛结构式中____(填“有”或“没有”)手性碳原子。
(3)A→B的反应类型为____。
(4)C→D反应的化学方程式为____。
(5)X是C的同分异构体,X中除苯环外不含其他环状结构,X能与FeCl3溶液发生显色反应,符合条件的X 的结构有____种,其中核磁共振氢谱为3组峰,峰面积之比为1:2:2的X的结构简式为____。
(6)参考上述流程,设计以CH2=CHCH2OH、乙酸、甲醇为起始原料合成![]() 的合成线路(无机试剂任选)____
的合成线路(无机试剂任选)____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com