
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| D | 738 | 1451 | 7733 | 10540 |
| E | 578 | 1817 | 2745 | 11578 |


查看答案和解析>>
科目:高中化学 来源: 题型:
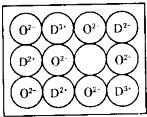 【化学-选修物质结构与性质】
【化学-选修物质结构与性质】查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ![]()
A.在周期表中,族序数都等于该元素的最外层电子数.![]()
B.非金属性最强的元素,其氢化物溶于水的酸性最强![]()
C.碱金属随原子序数增大,熔点降低;卤族元素的单质,随原子序数增大,熔点依次升高.![]()
D.同一周期的主族元素,从左至右,原子半径减小,它们所形成的简单离子半径从左至右依次增大
查看答案和解析>>
科目:高中化学 来源:09-10年如皋市高二下学期期末考试化学卷 题型:填空题
(12分)已知A、B、C、D、E、F均为周期表中前36号元素,且原子序数依次增大。A、B、C为同一周期的主族元素,B原子p能级电子总数与s能级电子总数相等。A、F原子未成对电子是同周期中最多的,且F基态原子中电子占据三种不同形状的原子轨道。D和E原子的第一至第四电离能如下表所示:
| 电离能/ kJ·mol-1 | I1 | I2 | I3 | I4 |
| D | 738 | 1451 | 7733 | 10540 |
| E | 578 | 1817 | 2745 | 11578 |
查看答案和解析>>
科目:高中化学 来源:09-10年如皋市高二下学期期末考试化学卷 题型:填空题
(12分)已知A、B、C、D、E、F均为周期表中前36号元素,且原子序数依次增大。A、B、C为同一周期的主族元素,B原子p能级电子总数与s能级电子总数相等。A、F原子未成对电子是同周期中最多的,且F基态原子中电子占据三种不同形状的原子轨道。D和E原子的第一至第四电离能如下表所示:
|
电离能/ kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
D |
738 |
1451 |
7733 |
10540 |
|
E |
578 |
1817 |
2745 |
11578 |
⑴A、B、C三种元素的电负性最大的是 ▲ (填写元素符号),D、E两元素中D的第一电离能较大的原因是 ▲ 。
⑵F基态原子的核外电子排布式是 ▲ ;在一定条件下,F原子的核外电子从基态跃迁到激发态产生的光谱属于 ▲ 光谱(填“吸收”或“发射”)。
⑶根据等电子原理,写出AB+的电子式: ▲ 。
⑷已知:F3+可形成配位数为6的配合物。组成为FCl3·6H2O的配合物有3种,分别呈紫色、蓝绿色、绿色,为确定这3种配合物的成键情况,分别取等质量的紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为3∶2∶1。则绿色配合物的化学式为 ▲ 。
A.[CrCl (H2O)5]Cl2·H2O B.[CrCl2(H2O)4]Cl·2H2O
C.[Cr(H2O)6]Cl3 D.[CrCl3(H2O)3] ·3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com