
取100 mL 2mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
A.加入适量的6mol/L的盐酸 B.用酒精灯适当加热
C.加入适量蒸馏水 D.加入适量的氯化钠溶液
科目:高中化学 来源:2015届山西省大同市高二上学期期末考试化学试卷(解析版) 题型:选择题
中国国家主席胡锦涛在中非合作论坛北京峰会上承诺:“提供3亿元人民币无偿援款帮助非洲防治疟疾,用于提供青蒿素药品及设立30个抗疟中心”。中国研制成功的全球唯一的治疗疟疾特效药——青蒿素,是数亿外国人眼中的“中国神药”,结构如图所示。目前售价每克225美元,世界年产量15吨,是需求量的十分之一,供不应求。下列关于青蒿素的说法正确的是

A.是一种烃 B.属于高分子化合物
C.属于芳香族化合物 D.分子式是C15H22O5
查看答案和解析>>
科目:高中化学 来源:2015届山东省威海市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列说法错误的是
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH小于4
B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.用0.200 mol·L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和
D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度: ④>①>②>③
查看答案和解析>>
科目:高中化学 来源:2015届天津市红桥区高二上学期期末考试化学试卷(解析版) 题型:填空题
电解原理在化学工业中有广泛的应用。如图表示一个电解池, 装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。

请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为 ,在X极附近观察到的现象是 。电解液中向X极方向移动的离子是 。
②Y电极上的电极反应式为 ,
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是
②Y电极的电极反应式为 (说明:杂质发生的反应不必写出。)
③溶液中的c(Cu2+)与电解前相比 (填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2015届天津市红桥区高二上学期期末考试化学试卷(解析版) 题型:选择题
下列实验基本操作正确的是
A.用碱式滴定管量取0.10 mol·L-1的Na2CO3溶液22.10 mL;
B.中和热测定实验中可以用环形铁丝搅拌棒代替环形玻璃搅拌棒
C.经实验测定等物质的量的盐酸、醋酸分别与足量NaOH溶液反应放出的热量相等
D.用玻璃棒蘸取溶液滴到湿润的广范pH试纸上,测其pH=3.6
查看答案和解析>>
科目:高中化学 来源:2015届天津市红桥区高二上学期期末考试化学试卷(解析版) 题型:选择题
在H2O+CH3COO-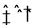 CH3COOH+OH-的平衡中,要使平衡向右移动,应采取的措施是
CH3COOH+OH-的平衡中,要使平衡向右移动,应采取的措施是
A.加入NaOH固体 B.加入冰醋酸 C.增大压强 D.升高温度
查看答案和解析>>
科目:高中化学 来源:2015届天津市和平区高二上学期期末考试化学试卷(解析版) 题型:填空题
请从图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25mL),并检验氯气的氧化性。

(1)A极发生的电极反应式是_____________________·B极发生的电极反应式是_______________________;电解饱和食盐水的化学方程式是______________________。
(2)电源的M端应连接的电极为____________(A或B)极。
(3)设计上述气体实验装置时,各接口的正确连接顺序为:______________________________
__________________________________(填接口编号)。
(4)实验中,在盛有KI淀粉溶液的容器中发生反应的离子方程式为________________。
(5)已知饱和食盐水50mL,某时刻测得H2体积为56mL(标准状况)。此时溶液pH约为___________________。
查看答案和解析>>
科目:高中化学 来源:2015届天津市和平区高二上学期期末考试化学试卷(解析版) 题型:选择题
对“ ”的理解正确的是( )。
”的理解正确的是( )。
A.说明AgCl没有完全电离,AgCl是弱电解质
B.说明溶解的AgCl已完全电离,AgCl是强电解质
C.说明Ag+与Cl-的反应不能完全进行到底
D.说明Ag+与Cl-的反应可以完全进行到底
查看答案和解析>>
科目:高中化学 来源:2015届天津市五区县高二上学期期末考试化学试卷(解析版) 题型:选择题
一定条件下,在密闭容器中进行如下反应:
 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度
B.加催化剂同时增大压强
C.升高温度同时充入N2
D.增大压强同时充入NO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com