
分析 (1)要使D的物质的量由d mol→$\frac{d}{2}$mol,需使平衡左移,且需C为d mol,此时,只需a>d即可;要使D的物质的量由d mol→2d mol,需使平衡右移,此时需A为d mol,需B为4d mol.因此,a应大于4 d,所以,a的取值范围为a>4d.
(2)D的物质的量只允许在d到2d之间取值,则平衡正向移动,由于没标明四种物质的状态,不能判断浓度、压强如何改变平衡,所以只能改变温度.
解答 解:(1)要使D的物质的量由d mol→$\frac{d}{2}$mol,需使平衡左移,则D转化$\frac{d}{2}$mol
A+4B?2C+D
起始(mol):a a a d
转化(mol):$\frac{d}{2}$ 2d d $\frac{d}{2}$
平衡(mol):a+$\frac{d}{2}$ a+2d a-d $\frac{d}{2}$
需C为d mol,则a-d>0,即a>d;
要使D的物质的量由d mol→2d mol,需使平衡右移,生成dmolD,
A+4B?2C+D
起始(mol):a a a d
转化(mol):d 4d 2d d
平衡(mol):a-d a-4d a+2d d
此时需A为d mol,需B为4d mol,a-4d>0,a>4d,所以a的取值范围为:a>4d.
故答案为:a>4d.
(2)D的物质的量只允许在d到2d之间取值,则平衡正向移动,由于没标明四种物质的状态,不能判断浓度、压强如何改变平衡,所以只能改变温度,已知该反应为放热反应,降低温度平衡正向移动,故D正确;
故答案为:D.
点评 本题考查了化学平衡的有关计算、影响化学平衡移动的因素等,题目难度中等,侧重于考查学生的分析能力和计算能力.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 某燃料电池用熔融碳酸盐作电解质,两极分别通入CO和O2,则通入CO的一极为负极,电极反应式为CO-2e-+CO32-=2CO2 | |
| B. | Zn粒与稀硫酸反应制氢气时,为加快反应速率,可在反应过程中滴加几滴CuSO4溶液 | |
| C. | 根据自发氧化还原反应Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O设计原电池,可在常温下用铜和铁作电极,使用浓硝酸作电解质溶液 | |
| D. | 原电池中电子从负极出发,经外电路流向正极,再从正极经电解液回到负极构成闭合回路 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠与硫酸氢钠反应:HCO3-+HSO4-═SO42-+H2O+CO2↑ | |
| B. | 硫酸与氢氧化钡反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 锌和稀硫酸反应:Zn+2H+═Zn2++H2↑ | |
| D. | 氧化铜和盐酸反应:O2-+2H+═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
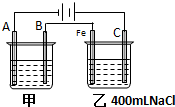 如图为相互串联的甲、乙两电解池试回答:
如图为相互串联的甲、乙两电解池试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 66 | 70 | 143 | 160 |
| 主要化合价 | -2 | +5、+3、-3 | +3 | +2 |
| A. | W和Y形成的化合物中含有离子键和非极性键 | |
| B. | 一定条件下,X单质可以将Y单质从其氢化物中置换出来 | |
| C. | Z的最高价氧化物能溶于氨水 | |
| D. | Y的简单气态氢化物的沸点高于 X的简单气态氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先后滴加紫色石蕊试液、BaCl2溶液,可以将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 | |
| B. | 用加入过量CuCl2溶液,再过滤,除去Cu(NO3)2溶液中混有的AgNO3 | |
| C. | 向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液中的SO42- | |
| D. | 某固体在加入稀盐酸产生了无色无味且能使澄清石灰水变浑浊的气体,证明该固体一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它的体积为2.24L | B. | 其摩尔体积为22.4L.mol-1 | ||
| C. | 含有氮分子数为0.4NA | D. | 其摩尔质量为28mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 加入0.2mol的MnO2粉末于100mL过氧化氢的溶液中(密度为1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题:
加入0.2mol的MnO2粉末于100mL过氧化氢的溶液中(密度为1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “低碳生活”既是时尚,也是环保要求.目前碳及其化合物的综合利用已成为科学家研究的重要课题.
“低碳生活”既是时尚,也是环保要求.目前碳及其化合物的综合利用已成为科学家研究的重要课题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com