
 �����ܱ������еķ�Ӧ��N2��g��+3H2��g��$?_{����}^{���¸�ѹ}$2NH3��g��������Ӧ�Ƿ��ȷ�Ӧ������673K��30MPa��n��NH3����n��H2����ʱ��仯��ϵ��ͼ��ʾ��
�����ܱ������еķ�Ӧ��N2��g��+3H2��g��$?_{����}^{���¸�ѹ}$2NH3��g��������Ӧ�Ƿ��ȷ�Ӧ������673K��30MPa��n��NH3����n��H2����ʱ��仯��ϵ��ͼ��ʾ������ N2��g��+3H2��g��?2NH3��g����Ӧ�У����ŷ�Ӧ�Ľ��У���Ӧ������ʵ������٣�����������ʵ��������࣬���ﵽƽ��״̬ʱ�����淴Ӧ������ȣ���Ӧ�������������ʵ������ٸı䣬����Ϊˮƽֱ�ߣ�
��1��ͼ�������֪��a�㰱�����������ʵ�����ʱ�䷢���仯��˵����Ӧδ�ﵽƽ��״̬����ʱ�������ʵ�����С���������ʵ������ӣ�˵����Ӧ������У�����Ӧ���ʴ����淴Ӧ���ʣ�c��������������ʵ�������ʱ��仯��˵����Ӧ�ﵽƽ��״̬�����淴Ӧ������ͬ��
��2����ʼ��һ����de�㰱����������֪���˲���ʱ��仯�ǻ�ѧƽ��״̬����ʱ�������ʵ������䣻
��3����ϻ�ѧƽ�����м�����ʽ����õ�������ʼ����
��4�������ı䷴Ӧ���ʲ��ı仯ѧƽ�⣬�ﵽƽ��״̬ʱ�������������ʵ������䣬�仯��б�������ˣ��ﵽƽ������ʱ�����ˣ��ݴ˻����仯�����ߣ�
��� �⣺��1��ͼ�������֪��a�㰱�����������ʵ�����ʱ�䷢���仯��˵����Ӧδ�ﵽƽ��״̬����ʱ�������ʵ�����С���������ʵ������ӣ�˵����Ӧ������У�����Ӧ���ʴ����淴Ӧ���ʣ�a��ʱ����Ӧ���ʣ��淴Ӧ���ʣ�c��������������ʵ�������ʱ��仯��˵����Ӧ�ﵽƽ��״̬�����淴Ӧ������ͬ��
c��ʱ����Ӧ����=�淴Ӧ���ʣ��ʴ�Ϊ������=��
��2����ʼ��һ����de�㰱����������֪���˲���ʱ��仯�ǻ�ѧƽ��״̬����ʱ�������ʵ������䣬d���e�㶼����ƽ��״̬��n��N2�����䣬��d���e��n��N2����ȣ�
�ʴ�Ϊ��d���e�㶼����ƽ��״̬��n��N2�����䣬��d���e��n��N2����ȣ�
��3��N2��g��+3H2��g��$?_{����}^{���¸�ѹ}$2NH3��g��
��ʼ����mol�� 1.3 0
�仯����mol�� 0.3 0.9 0.6
ƽ������mol�� 0.4 0.6
������ʼ��Ϊ1.3mol��
�ʴ�Ϊ��1.3��
��4�������ı䷴Ӧ���ʲ��ı仯ѧƽ�⣬�ﵽƽ��״̬ʱ�������������ʵ������䣬�仯��б�������ˣ��ﵽƽ������ʱ����٣�ͼ��Ϊ��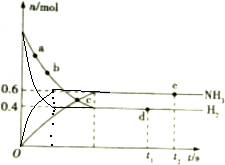 ��
��
�ʴ�Ϊ�� ��
��
���� ���⿼����ͼ�������������ѧƽ��Ľ������̺�ƽ�����������Ӧ�ã�ע��ͼ��Ļ���Ҫ����ˮ���е�ƽ�ⲻ�䣬��Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �е��ʲμӵķ�Ӧһ����������ԭ��Ӧ | |
| B�� | ȼ�շ�Ӧ������������������ | |
| C�� | 2Fe+3Cl2�T2FeCl3�� Fe+S$\frac{\underline{\;\;��\;\;}}{\;}$FeS �ɴ˿����ж������ԣ�Cl2��S | |
| D�� | Mg�ڻ�ѧ��Ӧ��ʧȥ2�����ӣ���Al�ڻ�ѧ��Ӧ��ʧȥ3�����ӣ���˻�ԭ��Al��Mg |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ڼ��� | B�� | Ư�����ڻ���� | ||
| C�� | ��������������� | D�� | ������̼�������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������Ż�ʱ����ϸɳ������� | |
| B�� | ��������������Ӧ��������ͬ�����ﲻͬ | |
| C�� | Na�Ļ�ѧ���ʱ�þ���ã�����Na��MgCl2��Һ��Ӧ��ȡ����þ | |
| D�� | 9.2g������������ˮ��Ӧ����Ӧ��������0.4mol����ת�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
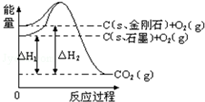
| A�� | ���ʯ���ȶ���ǿ��ʯī | |
| B�� | 12gʯī�ܼ��ܱ�12g���ʯС1.9kJ | |
| C�� | ʯī�ͽ��ʯ��ת���������仯 | |
| D�� | C��s��ʯī��=C��s�����ʯ����H=+1.9 kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.2molNa2O2 ��ȫ��ˮ��Ӧת�Ƶĵ�����Ϊ0.4NA | |
| B�� | 800mL 2mol•L-1�ƾ���Һ������������Ϊ0.6NA | |
| C�� | ���³�ѹ�£�1.6g O2��O3�Ļ����������������Ϊ0.8NA | |
| D�� | �ڳ��³�ѹ�£�2.24L NO2��O2���������������ԭ����Ϊ0.2NA |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com