
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1mol·L-1的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大排列的顺序是________(用字母编号填写)。
(2)常温下,0.1mol·L-1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是___(填字母)。
A.c(H+)
B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-)
D.c(OH-)/c(H+)
E.c(H+)·c(CH3COO-)/c(CH3COOH)
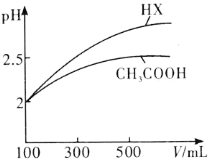
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
(4)标准状况下,将1.12L CO2通入100mL 1mol·L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:
①c(OH-)=2c(H2CO3)+________;
②c(H+)+c(Na+)=________。
(5)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精确值)。
【答案】a<d<c<bBD大于c(HCO3-)+c(H+)c(OH-)+c(HCO3-)+2c(CO32-)9.9×10-7
【解析】
(1)四种溶液的溶质都是强碱弱酸盐,根据相应酸的电离平衡常数可知水解程度大小为:CO32->ClO->HCO3->CH3COO-,水解均显碱性,水解程度越大,碱性越强,所以碱性顺序是:Na2CO3>NaClO>NaHCO3>CH3COONa,所以pH由小到大的排列顺序为:CH3COONa<NaHCO3<NaClO<Na2CO3,即a<d<c<b;
(2)常温下,0.1mol·L-1CH3COOH溶液加水稀释过程中,氢离子与醋酸根离子物质的量增大,浓度减小,酸性减弱,则
A、氢离子浓度减小,A错误;
B、加水稀释过程中,氢离子物质的量增大,醋酸分子物质的量减小,所以c(H+)/c(CH3COOH)增大,B正确;
C、c(H+)·c(OH-)表示水的离子积常数,温度不变,水的离子积常数不变,C错误;
D、醋酸溶液加水稀释时酸性减弱,氢离子浓度减小氢氧根离子浓度增大,所以c(OH-)/c(H+)增大,D正确;
E、c(H+)·c(CH3COO-)/c(CH3COOH)表示醋酸的电离平衡常数,温度不变,醋酸的电离平衡常数不变,E错误;
答案为BD;
(3)据图分析,加水稀释的过程中,HX的pH变化比较快,说明HX的酸性比醋酸强,HX的电离平衡常数比醋酸大;
(4)标准状况下,将1.12L CO2通入100mL 1mol·L-1的NaOH溶液中,1.12L CO2的物质的量为1.12L÷22.4L/mol=0.05mol,氢氧化钠的物质的量为1molL-1×0.1L=0.1mol,二者恰好完全反应生成碳酸钠,则
①溶液中存在质子守恒,则c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+);
②碳酸钠溶液中存在电荷守恒,则c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-);
(5)25℃时,CH3COOH与CH3COONa的混合溶液中存在电荷守恒c(H+)+c(Na+)=c(OH-)+c(CH3COO-),所以c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6mol/L-10-8mol/L=9.9×10-7mol/L。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】从淡化海水中提取溴的流程如下:

下列有关说法不正确的是
A. X试剂可用Na2SO3饱和溶液
B. 步骤Ⅲ的离子反应:2Br-+Cl2=2Cl-+Br2
C. 工业上每获得1molBr2,需要消耗Cl244.8L
D. 步骤Ⅳ包含萃取、分液和蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验:
①向Fe2(SO4)3和CuSO4的混合液中加入过量铁粉,充分反应,有红色固体析出,过滤。
②取①中滤液,向其中滴加KSCN溶液,观察现象。
判断下列说法正确的是
A. 氧化性Cu2+>Fe3+
B. ①中所得固体只含铜
C. ①中滤液含有Cu2+和Fe2+
D. ②中不会观察到溶液变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组探究NO和Na2O2的反应,设计了如下图所示实验装置,其中E为实验前压瘪的气囊。
资料:除浅黄色的AgNO2难溶于水外,其余亚硝酸盐均易溶于水。
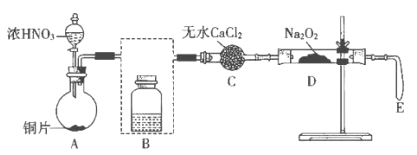
(1)写出A中反应的化学方程式:____________________________。
(2)将装置B补充完整,并标明试剂_____________。
(3)用无水CaCl2除去水蒸气的目的是_____________________________。
(4)反应一段时间后,D处有烫手的感觉,其中固体由淡黄色变为白色,直至颜色不再变化时,气囊E始终没有明显鼓起。
①学生依据反应现象和氧化还原反应规律推断固体产物为NaNO2。写出该反应的化学方程式:_________________________________。
②设计实验证明的NaNO2生成,实验方案是___________________________。(写出操作、现象和结论)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在 pH=5时沉淀完全).其中分析错误的是

A. 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B. 步骤②不能用氯水、硝酸等强氧化剂代替H2O2
C. 步骤③用 CuCO3代替CuO也可调节溶液的pH
D. 步骤④为过滤,步骤⑤蒸发结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中无机氮的循环过程可用如图表示。下列说法正确的是(已知:反应④的离子方程式为4NH4+ + 5O2![]() 2NO2- + 6H+ + N2O + 5H2O)
2NO2- + 6H+ + N2O + 5H2O)

A. ①②均属于固氮反应
B. 海洋中的反硝化作用一定需要氧气参加
C. 反应④中每生成1 mol H2O转移2 mol e-
D. 向海洋排放含NO3-的废水可能影响海洋中氮的循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当今环境保护越来越受重视,某化工集团为减少环境污染,提高资源的利用率、将钛厂、氯碱厂、甲醇厂进行联合生产。其主要生产工艺如下:(FeTiO3中Ti为+4价)

下列叙述正确的是
A. 该流程中只有“电解”、“氯化”涉及氧化还原反应
B. “氯化”时每消耗36g焦炭,则转移7mol电子
C. “合成”反应中氧化剂与还原剂的物质的量之比为1:1
D. 上述流程中“Mg,Ar"可用“Mg,CO2”代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若往20 mL 0.01 mol·L-1 HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示。下列有关说法不正确的是

A. HNO2的电离平衡常数:c点>b点
B. b点混合溶液显酸性:c(Na+)>c(NO2-)>c(H+)>c(OH-)
C. c点混合溶液中:c(OH-)>c(HNO2)
D. d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com