
均由两种短周期元素组成的A、B、C、D化合物分子,都含有18个电子,它们分子中所含原子的数目依次为2、3、4、6。A和C分子中的原子个数比为1∶1,B和D分子中的原子个数比为1∶2。D可作为火箭推进剂的燃料。
请回答下列问题:
(1)A、B、C、D分子中相对原子质量较大的四种元素第一电离能由大到小排列的顺序为
(用元素符号回答)。
(2)A与HF相比,其熔、沸点较低,原因是 。
(3)B分子的空间构型为 形,该分子属于 分子(填“极性”或“非极性”) 。
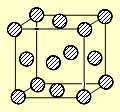
(4)C为一种绿色氧化剂,有广泛应用。请写出Cu、稀H2SO4与C反应制备硫酸铜的离子方程式 ,该反应中反应物Cu的基态原子电子排布式为 。铜晶体中铜原子的堆积方式为面心立方堆积,下图是铜晶体一个晶胞的示意图,则晶胞中含 个铜原子。
(5)D分子中心原子的杂化方式是 ,由该原子组成的单质分子中包含
个π键,与该单质分子互为等电子体的常见分子的分子式为 。
(13分)(1)N>O>Cl>S(2分)
(2)HF分子间形成氢键(1分) (3)V形(1分) 极性分子(1分)
(4)Cu+2H++H2O2=Cu2++2H2O(3分) [Ar]3d104s1(1分) 4(1分)
(5)sp3(1分) 2(1分) CO(1分)
【解析】
试题分析:常见18电子的微粒有:单核分子是Ar;离子是K+、Ca2+、CI-、S2-。双核分子是F2、HCI;离子是HS-。三核的分子是H2S。四核的分子是PH3、H2O2。五核的分子是SiH4。六核的分子是N2H4。根据分子中所含原子的数目依次为2、3、4、6。A和C分子中的原子个数比为1∶1,B和D分子中的原子个数比为1∶2。D可作为火箭推进剂的燃料可知,A是HCl,B是H2S,C是H2O2,D是N2H4。
(1)非金属性越强,第一电离能越大。但由于氮元素的2p轨道电子处于半充满状态,稳定性强,所以氮元素的第一电离能大于氧元素的,则A、B、C、D分子中相对原子质量较大的四种元素第一电离能由大到小排列的顺序为N>O>Cl>S。
(2)由于HF分子间形成氢键,所以HF的沸点高于HCl的沸点。
(3)H2S分子中中心原子S原子含有的孤对电子对数=(6-2×1)÷2=2,所以H2S是V形结构,属于极性分子。
(4)双氧水具有强氧化性,在酸性条件下和铜反应的离子方程式是Cu+2H++H2O2=Cu2++2H2O。根据构造原理可知,铜原子的核外电子排布式是[Ar]3d104s1。根据晶胞的结构并依据均摊法可知,晶胞中含 个铜原子。
个铜原子。
(5)在根据N2H4分子的结构可知,该化合物相当于是氨气中的1个氢原子被-NH2代替,所以根据氨气的结构式可知,N2H4分子中氮原子是sp3杂化。氮气中含有氮氮三键,所以含有1个α键和2个π键。由于原子数和价电子数分别都相等的是等电子体,则和氮气互为等电子体的是CO。
考点:考查核外电子排布式、杂化轨道类型、共价键、电负性、分子空间结构以及晶体类型的有关计算和判断
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。该题以“周期表中元素的推断”为载体,比较全面考查学生有关元素推断知识和灵活运用知识的能力。考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由X与Y组成的化合物的沸点可能高于由X与Z组成的化合物的沸点 | B、X、Z、R三种元素中的任意两种组合成的(1:1型)物质中均含有共价键 | C、常压条件下,沸点:X2Z2>XM;简单离子半径:Z>M>R>W | D、R3WM6晶体可作为工业电解熔融W2Y3制W单质时的助熔剂 |
查看答案和解析>>
科目:高中化学 来源:2012届河北省正定中学高三第二次综合考试化学试卷(带解析) 题型:填空题
(10分)水是生命之源,也是化学反应中的主角。请回答下列问题:(下列问题
所涉及的答案可能有多种,只需答出一种情况即可)
I.水是一种电解质,发生电离会产生电子总数相同的两种微粒,其电离的方程式为
。
Ⅱ.有以下五组离子① K+、Cl-、NO3-、S2- ;② K+、Fe2+、I-、SO42- ;③ Na+、Cl-、
NO3-、SO42-;④Na+、Ca2+、Cl-、HCO3-;⑤ K+、Ba2+、Cl-、NO3-。在由水电离产生的
c(OHˉ)= 1×10ˉ13mol/L溶液中,一定不能大量共存的离子组是 (填序号)
Ⅲ.在许多反应中H2O扮演不同的“角色”。请结合所学完成下列反应
(1)H2O参与的置换反应:符合X+W→Y+V,已知X和Y分别是短周期同主族两种元素形成的单质, W、V是化合物
①W是水,离子方程式为 ;
②V是水,化学方程式为 。
(2)水既不是氧化剂也不是还原剂的氧化还原反应:
A、B是中学化学常见的两种由短周期元素组成的有色气体,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,写出A、B与水反应的化学方程式:
①A + H2O ;
②B + H2O ;
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省协作体高三第一次联考理综化学试卷(解析版) 题型:选择题
X、Y、Z、M、R、W为六种短周期元素,原子序数依次递增。Y、Z、M是同周期元素,且Z、M最外层电子数之差为1。X+ 无电子,—ZX是有机物中常见官能团。Y是组成化合物最多的元素,组成为R ZX的物质能溶解W2Z3型物质。下列说法不正确的是
A.由X与Y组成的化合物的沸点可能高于由X与Z组成的化合物的沸点
B.X、Z、R三种元素中的任意两种组合成的(1∶1型)物质中均含有共价键
C.常压条件下,沸点:X2Z2>XM ;简单离子半径:Z>M>R>W
D.R 3WM6晶体可作为工业电解熔融W2Y3制W单质时的助熔剂
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省绍兴市高三回头考试化学试卷 题型:填空题
A、B、R、D、E、F是六种原子序数依次增大的短周期元素, 其中有两种非金属元素位于同一主族。已知A、B、D均能与R形成原子(或离子)个数不同的几种常见化合物。请回答下列有关问题。
(1)仅由上述信息就可以确定的元素(写出代号与元素符号)是________________,若X、Y是D、F形成的最高价氧化物对应的水化物,浓度均为0.1mol/L的X、Y溶液的pH之和为14,则X、Y的晶体熔点相对高低为(写化学式)______ ______
(2) A与B、E均可形成正四面体构型的气态分子Q、P,又知P的燃烧热为1430kJ/mol,则其燃烧的热化学方程式___________ _________
(3) 上述六种元素间能形成多种常见二元化合物,其中存在两类化学键的物质的电子式为_____ __(写一种即可)
(4) R能形成多种单质,如R2、R3,研究表明,新近制得的一种组成为R4的分子中,每个R原子均与另外两个R原子各形成一个键,下列有关R4的说法中正确的是__ _____
①R4与R3、R2互为同位素 ②R4不能与A、B、D的单质反应
③R4中各原子最外电子层均为8电子结构 ④R4是一种新型化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com