
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)CO(g)+3H2(g) H1=+216.4kJ/mol
b. CO(g)+H2O(g)CO2(g)+H2(g) H2=-41.2kJ/mol
则反应CH4(g)+2H2O(g)CO2(g)+4H2(g) H= _____________。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
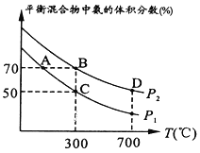
①恒压时,反应一定达到平衡状态的标志是_____________(填序号)
A.![]() 和
和![]() 的转化率相等 B.反应体系密度保持不变
的转化率相等 B.反应体系密度保持不变
C.![]() 保持不变 D.
保持不变 D.![]()
②P1_____P2 (填“<”或“>”或“=”或“不确定”,下同);反应的平衡常数:B点_______D点。
③C点![]() 的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________υ(B)。
的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________υ(B)。
【答案】+175.2kJ/mol BC < > 66.7% <
【解析】
(1)已知:a. CH4(g)+H2O(g)CO(g)+3H2(g) H1=+216.4kJ/mol
b. CO(g)+H2O(g)CO2(g)+H2(g) H2=-41.2kJ/mol
则将a+b可得CH4(g)+2H2O(g)CO2(g)+4H2(g) H= (+216.441.2)kJ/mol=+175.2kJ/mol
答案为:+175.2kJ/mol
(2)①A.N2和H2的物料比为1:3,且按照1:3反应,则无论是否达到平衡状态,转化率都相等,不能用于判断是否达到平衡状态,故A错误;
B. 气体的总质量不变,恒压条件下,当反应体系密度保持不变时,说明体积不变,则达到平衡状态,故B正确;
C.![]() 比值为保持不变,说明氮气、氨气的浓度不变,能确定是否达到平衡状态,故C正确;
比值为保持不变,说明氮气、氨气的浓度不变,能确定是否达到平衡状态,故C正确;
D. 因平衡常数等未知,![]() ,不能确定是否平衡状态,故D错误。
,不能确定是否平衡状态,故D错误。
故答案为:BC;
②增大压强,平衡正向移动,平衡混合气体中氨气的百分含量增大,由图象可知P1<P2,升高温度,平衡逆向移动,平衡常数减小,则反应平衡常数:B点>D点,
故答案为:<;>;
③起始时投入氮气和氢气分别为1mol、3mol,反应的方程式为N2(g)+3H2(g)2NH3(g),C点氨气的含量为50%,则
N2(g)+3H2(g)2NH3(g)
起始:1mol3mol0
转化:xmol3xmol2xmol
平衡:(1x)mol(33x)mol2xmol
则![]() =50%,x=
=50%,x=![]() ,
,
C点H2的转化率为![]() ×100%=66.7%,温度越高,反应速率越大,则v(A)<v(B),
×100%=66.7%,温度越高,反应速率越大,则v(A)<v(B),
故答案为:66.7%;<;


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】在恒温恒容下使NH2COONH4 (s)![]() 2NH3 (g)+CO2(g)达到平衡,不可以判断该反应达到化学平衡的是( )
2NH3 (g)+CO2(g)达到平衡,不可以判断该反应达到化学平衡的是( )
A.V正(NH3) =2V逆(CO2)
B.密闭容器中氨气的体积分数不变
C.密闭容器中总压强不变
D.密闭容器中混合气体的密度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下的一密闭容器中事先放入1.56g过氧化钠,然后再通入乙烷与氧气的混合气体,用电火花引爆,直至反应完全为止,恢复到原温度,容器内压强近似为零。
(1)相同条件下,通入的气体氧气和乙烷的体积比是多少?_____
(2)通入氧气的质量最大应是多少?_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合气体由一种气态烷烃和一种气态烯烃(含一个双键)组成,在同温同压下,混合气体对氢气的相对密度13,在标准状况下,将56L混合气体通入足量的溴水中,溴水的质量增重35g。
(1)计算确定混合气体中烃的化学式_____。
(2)混合气体中两种烃的物质的量之比_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某学生自己总结的一些规律,其中正确的是( )
A.氧化物不可能是分解反应的产物
B.有些化学反应不属于化合、分解、置换、复分解中的任何一种反应
C.根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等
D.饱和溶液一定比不饱和溶液的浓度大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应:![]() 在某密闭容器中达到平衡,下列说法不正确的是
在某密闭容器中达到平衡,下列说法不正确的是
A.![]()
B.![]() ,反应达到平衡,升高温度,有利于平衡逆移
,反应达到平衡,升高温度,有利于平衡逆移
C.![]() ,若在恒温下压缩容器体积,氨基甲酸铵固体的质量增大
,若在恒温下压缩容器体积,氨基甲酸铵固体的质量增大
D.![]() ,在密闭容器中达到平衡,混合气体的平均相对分子质量不变,则反应一定达到平衡
,在密闭容器中达到平衡,混合气体的平均相对分子质量不变,则反应一定达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁钉在氯气中被锈蚀为棕褐色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液。在Cl2、Cl-、H+中,具有氧化性的是____________,其中氧化性最强的是____________。
(2)盐酸在不同的反应中可以分别表现出酸性、氧化性和还原性。现在有如下三个反应,请写出盐酸在三个反应中分别起何种作用:
①Zn+2HCl===ZnCl2+H2↑____________________;
②NaOH+HCl===NaCl+H2O__________________;
③2HCl![]() H2↑+Cl2↑________________________。
H2↑+Cl2↑________________________。
(3)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成浅绿色溶液(FeCl2);向浓盐酸中滴加KMnO4溶液产生淡黄绿色气体(Cl2)。在Cl2、H+、![]() 中,__________________氧化性最强。
中,__________________氧化性最强。
(4)高锰酸钾与氢溴酸溶液可以发生下列反应:2KMnO4+16HBr===5Br2+2MnBr2+2KBr+8H2O。其中还原剂是________________。若消耗15.8 g氧化剂,则被氧化的还原剂的质量是______________g。HBr的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应中能量变化,能更好地利用化学反应为生产和生活服务。
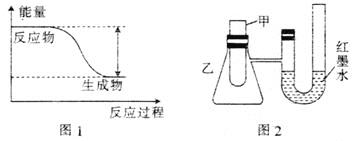
(1)反应Fe+H2SO4=FeSO4+H2↑的能量变化如图1所示。
①该反应为 __________(填“吸热”或“放热”)反应。
②为了探究化学能与热能的转化,某实验小组设计了图2实验装置,在甲试管里先加入适量铁片,再加入稀硫酸,U形管中可观察到的现象是__________。
③若要使该反应的反应速率加快,下列措施可行的是__________(填字母)。
A.铁片改为铁粉 B.稀硫酸改为98%的浓硫酸 C.升高温度
(2)若将上述反应设计成原电池,装置如图3所示。
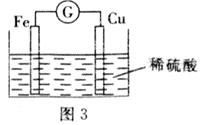
①铜为 __________(填“正”或“负”)极;负极的电极反应式为______。
②若该电池反应过程中共转移0.3 mol电子,则生成的H2在标准状况下的体积是__________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化合物A是一种不稳定的物质,它的分子组成可用OxFy表示。10mLA气体 能分解生成15mLO2和10mLF2(在同温同压下),A的化学式是_____。
(2)VLFe2(SO4)3溶液中含有agSO42-,取此溶液0.5VL,用水稀释至2VL,则稀释后溶液中 Fe3+的物质的量的浓度为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com