
根据所学知识,回答以下问题:
(1)Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂推测Ni(CO)4是____________分子(填“极性”或“非极性”)。
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4的结构式为 ;NH4+的空间构型是 。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) △H=-1038.7 kJ·mol-1若该反应中有259.7kJ能量释放时,则形成的π键有______mol。
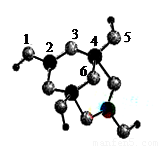
(3)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示:则Xm-的化学式为 ,硼原子轨道的杂化类型有 杂化,原子3的轨道杂化类型为 杂化,Na+与Xm-之间的作用力是 。
(4)BN晶体,具有熔沸点高,耐磨擦和较高的硬度等性质。则BN的晶体类型是 ,N的价层电子的电子排布图为 。
(1)非极性(1分) (2)①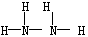 (2分) 正四面体 (1分)② 1.5mol(2分)
(2分) 正四面体 (1分)② 1.5mol(2分)
(3)[B4O5(OH)4]2-(2分),Sp2和Sp3,Sp3(3分),离子键(1分)
(4)原子晶体(1分),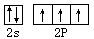 (2分)。
(2分)。
【解析】
试题分析:(1)Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂,这些性质说明该化合物应该是分子晶体。根据相似相溶原理可知,Ni(CO)4是非极性分子。
(2)①肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物,则根据氨气的金刚石可知,N2H4的结构式为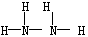 。由于在NH4+中氮原子的4个价电子全部参与成键,不存在孤对电子,所以NH4+的空间构型是正四面体结构。
。由于在NH4+中氮原子的4个价电子全部参与成键,不存在孤对电子,所以NH4+的空间构型是正四面体结构。
②根据热化学方程式可知,如果该反应中有259.7kJ能量释放时,则参加反应的肼的物质的量是259.7kJ÷1038.7 kJ/mol=0.25mol,则生成0.75mol氮气。又因为三键是由2个π键和1个α键构成的,则形成的π键有0.75mol×2=1.5mol。
(3)①1,3,5,6代表氧原子,2,4代表B原子。3号氧原子形成2个单键,所以氧原子是sp3杂化。2号B形成3个键,则B原子为sp2杂化,4号B形成4个键,则B原子为sp3杂化; B一般是形成3个键,4号B形成4个键,其中1个键很可能就是配位键,配位键存在4号与5号之间。观察模型可知Xm-是(H4B4O9)m-,依据化合价H为+1,B为+3,O为-2,可得m=2,则化学式为[B4O5(OH)4]2-。该微粒和钠离子形成的应该是离子键。
(4)BN晶体,具有熔沸点高,耐磨擦和较高的硬度等性质,这些性质说明,BN的晶体类型是原子晶体,根据构造原理、泡利原理和洪特规则可知,N的价层电子的电子排布图为 。
。
考点:考查核外电子排布图、杂化轨道类型、化学键、分子极性、分子空间结构以及晶体类型的有关计算和判断
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。该题以“周期表中元素的推断”为载体,比较全面考查学生有关元素推断知识和灵活运用知识的能力。考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。


科目:高中化学 来源: 题型:

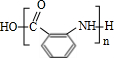



 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有 最合理的方案(不超过4步).
最合理的方案(不超过4步).| 浓硫酸 |
| 170℃ |
| Br2 |
| C | ||
|
| C | ||
|
查看答案和解析>>
科目:高中化学 来源: 题型:
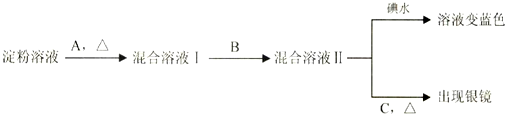
查看答案和解析>>
科目:高中化学 来源:2014届江苏省高一上学期期中考试化学试卷 题型:实验题
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。根据所学知识,回答下列问题:
⑴工业上将氯气通入石灰乳制取漂白粉,反应的化学反应方程式为 ;漂白粉有效成分为(填名称) ;瓶装漂白粉久置空气中会呈稀粥状而失效,试用化学方程式表示失效的原因 。
(2)某化学兴趣小组为了探究HClO的漂白性,设计了如下的实验。
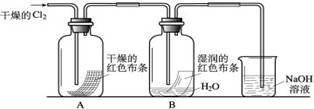
a.通入Cl2后,从集气瓶A、B的现象可得出的结论是 ;其中发生的反应的化学方程式为 。
b.为了确认是HClO使湿润的红色布条褪色,你认为还应增加的实验是 。
c.烧杯中溶液所起的作用是 ,烧杯中所发生反应的化学方程式为 。
d.为保证实验安全,氯气以每分钟1.12L(已换算为标准状况下)的流速匀速通入,若实验需耗时4分钟,小烧杯中盛放2 mol·L—1的NaOH溶液的体积至少应为 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。根据所学知识,回答下列问题:
⑴工业上将氯气通入石灰乳制取漂白粉,反应的化学反应方程式为 ;漂白粉有效成分为(填名称) ;瓶装漂白粉久置空气中会呈稀粥状而失效,试用化学方程式表示失效的原因 。
(2)某化学兴趣小组为了探究HClO的漂白性,设计了如下的实验。
a.通入Cl2后,从集气瓶A、B的现象可得出的结论是 ;其中发生的反应的化学方程式为 。
b.为了确认是HClO使湿润的红色布条褪色,你认为还应增加的实验是 。
c.烧杯中溶液所起的作用是 ,烧杯中所发生反应的化学方程式为 。
d.为保证实验安全,氯气以每分钟1.12L(已换算为标准状况下)的流速匀速通入,若实验需耗时4分钟,小烧杯中盛放2 mol·L—1的NaOH溶液的体积至少应为 mL。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省扬州中学高一上学期期中考试化学试卷 题型:实验题
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。根据所学知识,回答下列问题:
⑴工业上将氯气通入石灰乳制取漂白粉,反应的化学反应方程式为 ;漂白粉有效成分为(填名称) ;瓶装漂白粉久置空气中会呈稀粥状而失效,试用化学方程式表示失效的原因 。
(2)某化学兴趣小组为了探究HClO的漂白性,设计了如下的实验。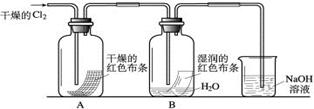
a.通入Cl2后,从集气瓶A、B的现象可得出的结论是 ;其中发生的反应的化学方程式为 。
b.为了确认是HClO使湿润的红色布条褪色,你认为还应增加的实验是 。
c.烧杯中溶液所起的作用是 ,烧杯中所发生反应的化学方程式为 。
d.为保证实验安全,氯气以每分钟1.12L(已换算为标准状况下)的流速匀速通入,若实验需耗时4分钟,小烧杯中盛放2 mol·L—1的NaOH溶液的体积至少应为  mL。
mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com