
【题目】常温下,用0.1mol·L-1MgSO4和0.05mol·L-1Al2(SO4)3溶液进行实验:①各取25mL,分别滴加0.5mol·L-1NaOH溶液,测得溶液pH与V(NaOH)的关系如图1;②将两种溶液等体积混合后,取出25mL,逐滴加入上述NaOH溶液,观察现象。下述正确的是 ( )
图1 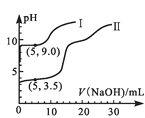 图2
图2
A.图1中的曲线II表示MgSO4与NaOH反应的关系
B.根据图1可得Ksp[Al(OH)3]的值大于1.0×10-32
C.实验②中Al(OH)3完全溶解前,溶液中c(Mg2+)/c(Al3+)逐渐变大
D.图2可以表示实验②中n(沉淀)与V(NaOH)的关系
【答案】C
【解析】
A.Mg的金属性强于Al,Mg(OH)2的碱性强于Al(OH)3,浓度相同的Mg2+水解程度小于Al3+,V(NaOH)=0时,相同浓度的镁铝离子溶液中MgSO4pH大,故图1中的曲线I表示MgSO4与NaOH反应的关系,与题意不符,A错误;
B.图1中(5,3.5)点时溶液中c(H+)=10-3.5mol/L,c(OH-)=10-10.5mol/L,若铝离子未反应,则c(Al3+)=![]() =0.08mol/L,Ksp[Al(OH)3]=c(Al3+)×c3(OH-)=0.08×(10-10.5)3=8×10-33.5<1.0×10-32,与题意不符,B错误;
=0.08mol/L,Ksp[Al(OH)3]=c(Al3+)×c3(OH-)=0.08×(10-10.5)3=8×10-33.5<1.0×10-32,与题意不符,B错误;
C.由图1可知,Al3+先沉淀,Mg2+后沉淀,并且pH=5时Al3+沉淀完全,pH=9时Mg2+开始沉淀、Al(OH)3开始溶解,实验②溶液中,随着NaOH的加入,Al3+先沉淀到完全、再溶解,所以Al(OH)3完全溶解前,溶液中c(Mg2+):c(Al3+)逐渐增大,符合题意,C正确;
D.25mL实验②溶液中n(Al3+)=n(Mg2+)=0.5×25×10-3L×0.1mol/L=1.25×10-3mol,由Al3+~Al(OH)3~3OH-可知,Al3+完全沉淀时消耗V(NaOH)=1.25×103mol×3×0.5mol/L=7.5mL,再加入5mlNaOH即加入NaOH总体积为12.5mL时,溶液中c(OH-)=5×0.5×103mol×(25+7.5+5)×103L=0.067mol/L,pH≈12.8>9,此时Al(OH)3几乎溶解完全、Mg(OH)2几乎沉淀完全,所以加入NaOH体积大于7.5ml时,Al(OH)3开始溶解而减少、Mg(OH)2沉开始淀,所以实验②中n(沉淀)与V(NaOH)的关系不是直线上升的关系,即不能表示实验②中n(沉淀)与V(NaOH)的关系,与题意不符,D错误;
答案为C。


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】“春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法错误的是( )
A. 蚕丝属于天然高分子材料
B. 蚕丝的主要成分是蛋白质
C. 古代的蜡是高级脂肪酸酯,属于高分子聚合物
D. “蜡炬成灰”过程中发生了氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
I.乳酸(![]() )、酒精、醋酸、淀粉等都是生活中常见的物质。
)、酒精、醋酸、淀粉等都是生活中常见的物质。
(1)在生活中,常选择上述物质中_______________(填结构简式)清洗水壶里的水垢。
(2)生活中常选择_______________酒精![]() 选择“75%”“95%”或“无水”
选择“75%”“95%”或“无水”![]() 皮肤消毒。
皮肤消毒。
(3)上述物质中,属于天然高分子化合物的是_________________![]() 填名称
填名称![]() 。
。
(4)乳酸中发生如下变化:![]() ,则所用的试剂a为________(写化学式)。
,则所用的试剂a为________(写化学式)。
II.X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | X的最外层电子数是次外层的2倍 |
Y | M层上的电子数是K层的3倍 |
Z | Z的一种核素的质量数为53,中子数为34 |
W | W2+与氖原子具有相同核外电子排布 |
(5)X在元素周期表中的位置为___________;Y元素的名称为________________。
(6)元素W的离子结构示意图是_______________;Z、Y形成的化合物为____________(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)和铜(Cu)在生产生活中有广泛的应用。硒可以用作光敏材料、电解锰行业的催化剂,也是动物体必需的营养元素和对植物有益的营养元素等。氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下所示:
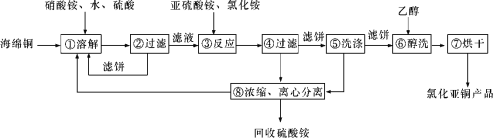
请回答下列问题:
(1)若步骤①中得到的氧化产物只有一种,则它的化学式是____________。
(2)写出步骤③中主要反应的离子方程式:____________________________________。
(3)步骤⑤包括用pH=2的溶液酸洗、水洗两步操作,酸洗采用的酸是__________(写酸的名称)。
(4)上述工艺中,步骤⑥和⑦的作用是_____________。
(5)Se为ⅥA族元素,用乙二胺四乙酸铜阴离子水溶液和硒代硫酸钠(Na2SeSO3)溶液反应可获得纳米硒化铜,硒代硫酸钠还可用于Se的精制,写出硒代硫酸钠(Na2SeSO3)与H2SO4溶液反应得到精硒的化学方程式:_____。
(6)氯化亚铜产率与温度、溶液pH关系如下图所示。据图分析,流程化生产氯化亚铜的过程中,温度过低影响CuCl产率的原因是____________________________________;温度过高、pH过大也会影响CuCl产率的原因是_______________________________。
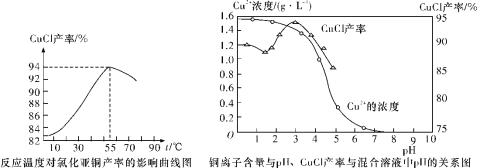
(7)用NaHS作污水处理的沉淀剂,可以处理工业废水中的Cu2+。已知:25℃时,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15,CuS的溶度积为Ksp(CuS)=6.3×10-36。反应Cu2+(aq)+HS-(aq) ![]() CuS(s)+H+(aq)的平衡常数K=__________(结果保留1位小数)。
CuS(s)+H+(aq)的平衡常数K=__________(结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B是短周期元素m、n组成的常见二元化合物(原子序数m<n),常温下均为气体。X是一种能被磁铁吸引的金属单质,C、D、E为化合物。上述物质的转化关系如图所示。下列说法错误的是( )
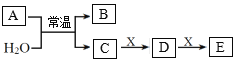
A.元素的非金属性m<n
B.常温下,C的浓溶液能溶解X
C.B可通过化合反应生成A
D.D→E的离子方程式为: 2X3+ + X=3X2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
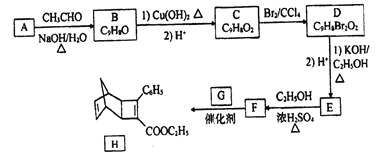
已知:①RCHO+CH3CHO ![]() RCH=CHCHO+H2O
RCH=CHCHO+H2O
②![]()
回答下列问题:
(1) E的结构简式为_______。
(2) E生成F的反应类型为_______。
(3) 1mol化合物H最多可与_______molH2发生加成反应。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为______。
(5)芳香化合物X是F同分异构体,X能与饱和碳酸氢钠反应放出CO2,其核磁共振氢谱显示有4种不同化学环境氢,峰面积比之为6:2:1:1,写出1种符合要求的X的结构简式_____。
(6)写出用环戊烷和2-丁炔为原料制备化合物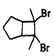 的合成路线(其他试剂任选)_____。
的合成路线(其他试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与![]() 互为同分异构体的是( )
互为同分异构体的是( )
A.OHCCH2CH2CHOB.CH3CH2OCH2CH2OH
C.CH3CH=CHCOOHD.HOCH2CH=CHCH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法正确的是
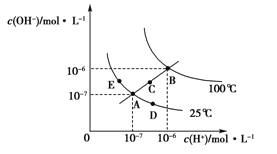
A. 图中五点KW间的关系:B>C>A=D=E
B. 若从A点到D点,可采用在水中加入少量NaOH的方法
C. 若从A点到C点,可采用温度不变时在水中加入适量H2SO4 的方法
D. 若处在B点时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com