
| c(CH3OH) |
| c(CO)��c2(H2) |
| c(CH3OH) |
| c(CO)��c2(H2) |
| n(CH3OH) |
| n(CO) |
| ��c |
| ��t |
| n(CH3OH) |
| n(CO) |
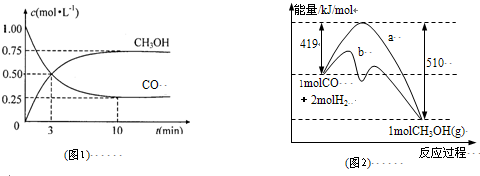
 CH3OH��g��
CH3OH��g��| 0.75mol/L |
| 10min |
 CH3OH��g����H=419KJ/mol-510KJ/mol�T-91kJ?mol-1������ֻ�ܸı䷴Ӧ�Ļ�ܣ����ı䷴Ӧ�ȣ�
CH3OH��g����H=419KJ/mol-510KJ/mol�T-91kJ?mol-1������ֻ�ܸı䷴Ӧ�Ļ�ܣ����ı䷴Ӧ�ȣ�| c(CH3OH) |
| c(CO)��c2(H2) |
| c(CH3OH) |
| c(CO)��c2(H2) |
| n(CH3OH) |
| n(CO) |
| n(CH3OH) |
| n(CO) |
| n(CH3OH) |
| n(CO) |
| n(CH3OH) |
| n(CO) |
 ��
�� ��
��| 1 |
| 2 |
| 1 |
| 2 |
| ||


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
��I������ѡ���⣨6�֣�
��ѧ���ѧ����������ᡢ����������أ�������������ȷ����__________��
A�������Ҵ�����(����������һ�������Ҵ�)���������ܽ��ͻ�����β�����к������ŷ�
B����ҵ����ʯ�����úȼ�պ��γɵ��������������������Ƶ�ʯ��
C��Ϊ����Ч�ķ�չ�����Դ�����õ��ˮ�ķ��������Ʊ�H2
D������ͣ������װ�������ʩ���ɽ�����β����CO��NOx��Ӧ����������
E�����û�ѧ��Ӧԭ������ƺ������µ�ҩ��
��II����14�֣�
��嫵ĺ�����һ�������Դ���⣬�̲��ŷ��ĵĿ�����DZ���Ļ�ѧ��Դ����ͼ�Ǻ�ˮ�ӹ���ʾ��ͼ��������ͼ�ش����⡣

��1����ˮ��������ͨ�����õ��Ʊ���ˮ�ķ����� ��д�����֣���
��2����ͼ�Ǵ�Ũ����ˮ����ȡ�������ͼ��д����ͼ�Т٢ڵĻ�ѧʽ���� ���� ���������з����Ļ�ѧ��Ӧ����ʽΪ ��

��3���Ʊ�����þ��ͨ��������ڵ�MgC12��������MgO����ԭ���� ��
��4��ʳ��Ҳ��һ����Ҫ�Ļ���ԭ�ϣ��ȼҵ����ͨ����ⱥ��ʳ��ˮ���Ʊ�NaOH��H2��C12����ˮ�еõ��Ĵ�������������һЩ���ʣ��������һЩ��ѧ�Լ���ʹ���ʳ��������������ˮ������������ӽ���������ԭ���� �����ʳ��ˮ�����ӽ���Ĥ�����н��У����ӽ���Ĥ�������� ��
��5���ྦྷ����Ҫ����SiHCl3��ԭ�����������丱����SiCl4��ת��ΪSiHCl3��ѭ��ʹ�á�һ�������£���20L�����ܱ������еķ�Ӧ��3SiCl4��g��+2 H2��g��+Si��g�� 4SiHCl3��g������ƽ���H2��SiHCl3���ʵ���Ũ�ȷֱ�Ϊ0.140mol/L��0.020mol/L����H2ȫ����Դ���ȼҵ�������������Ĵ�NaCl������Ϊ kg��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011�캣��ʡ�����и�����ѧ�ڸ߿����в��ԣ�������ѧ�Ծ� ���ͣ������
��I������ѡ���⣨6�֣�
��ѧ���ѧ����������ᡢ����������أ�������������ȷ����__________��
| A�������Ҵ�����(����������һ�������Ҵ�)���������ܽ��ͻ�����β�����к������ŷ� |
| B����ҵ����ʯ�����úȼ�պ��γɵ��������������������Ƶ�ʯ�� |
C��Ϊ����Ч�ķ�չ�����Դ�����õ��ˮ�ķ����� ���Ʊ�H2 ���Ʊ�H2 |
| D������ͣ������װ�������ʩ���ɽ�����β����CO��NOx��Ӧ���������� |

 ������ͼ��д����ͼ�Т٢ڵĻ�ѧʽ���� ���� ���������з����Ļ�ѧ��Ӧ����ʽΪ ��
������ͼ��д����ͼ�Т٢ڵĻ�ѧʽ���� ���� ���������з����Ļ�ѧ��Ӧ����ʽΪ ��
 4 SiHCl3��g������ƽ���H2��SiHCl3���ʵ���Ũ�ȷֱ�Ϊ0.140mol/L��0.020mol/L����H2ȫ����Դ���ȼҵ�������������Ĵ�NaCl��
4 SiHCl3��g������ƽ���H2��SiHCl3���ʵ���Ũ�ȷֱ�Ϊ0.140mol/L��0.020mol/L����H2ȫ����Դ���ȼҵ�������������Ĵ�NaCl�� ����Ϊ kg��
����Ϊ kg���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��㶫ʡ�����и����ڶ��θ߿�ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ�������
�ϳɰ�Ȼ������������������Ҫ�Ļ���������
I����3��2 L���ܱ������У�����ͬ���¶��¡�ʹ����ͬ�Ĵ����ֱ���з�Ӧ��
3H2(g) + N2(g) 2NH3(g)������ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ�й��������£�
2NH3(g)������ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ�й��������£�
|
|
�� |
�� |
�� |
|
��Ӧ��Ͷ���� |
3 mol H2��2 mol N2 |
6 mol H2��4mol N2 |
2 mol NH3 |
|
�ﵽƽ���ʱ��/min |
|
5 |
8 |
|
ƽ��ʱN2��Ũ��/mol��L��1 |
c1 |
1.5 |
|
|
NH3��������� |
��1 |
|
��3 |
|
��������ܶ�/g��L��1 |
��1 |
��2 |
|
��1���������з�Ӧ�ӿ�ʼ����ƽ��ķ�Ӧ����Ϊv(H2)=___________��
��2���ڸ��¶��¼������з�Ӧ��ƽ�ⳣ��K= (�ú�c1�Ĵ���ʽ��ʾ)��
��3�������ϱ����ݣ����й�ϵ��ȷ����________������ţ���
a��2c1 > 1.5 b��2��1 = ��2 c����3 = ��1
II����ҵ���ð����ϳ����أ�H2NCONH2���ķ�Ӧ�ڽ���ʱ��Ϊ����������
��һ����2NH3(l)��CO2(g) H2NCOONH4 (l) (���������)
��H1
H2NCOONH4 (l) (���������)
��H1
�ڶ�����H2NCOONH4(l) H2O(l)��H2NCONH2(l)
��H2
H2O(l)��H2NCONH2(l)
��H2
��4��ijʵ��С��ģ�ҵ�Ϻϳ����ص���������һ���Ϊ0.5 L�ܱ�������Ͷ��4 mol����1mol������̼��ʵ���÷�Ӧ�и������ʱ��ı仯������ͼI��ʾ��

����֪�ܷ�Ӧ�Ŀ���������һ����������ϳ������ܷ�Ӧ�Ŀ����ɵ� ����Ӧ������
�ڵڶ�����Ӧ��ƽ�ⳣ��K���¶�T�ı仯������ͼII��ʾ�����H2 0��������һ����Ӧ����ʱ����Ũ����������ͼII�л�����һ����ӦK1���¶�T�仯���ߣ���������Ҫ�ı�ע��
��5������������Һ��������������ҵβ���е�NO��NO2������ת��ΪN2��
��������NO��NO2���ߵ����ʵ�����ӦΪ��CO(NH2)2+NO+NO2 =CO2+2N2+2H2O
�÷�Ӧ�е�������Ϊ ��д��ѧʽ����
����֪��N2(g)+O2(g)= 2NO(g) ��H =a kJ��mol��1
N2(g)+3H2(g)= 2NH3(g) ��H2=bkJ�� kJ��mol��1
2H2(g)+O2(g)= 2H2O(g) ��H = c kJ��mol��1
��4NH3(g) +4NO(g) +O2(g)= 4N2(g)+6H2O(g) ��H= ��
������ȼ�ϵ�ؽṹ����ͼ��ʾ���乤��ʱ�����缫��Ӧʽ�ɱ�ʾΪ ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ�꺣��ʡ�����и�����ѧ�ڸ߿����в��ԣ�������ѧ�Ծ� ���ͣ������
��I������ѡ������6�֣�
��ѧ���ѧ����������ᡢ����������أ�������������ȷ����__________��
A�������Ҵ�����(����������һ�������Ҵ�)���������ܽ��ͻ�����β�����к������ŷ�
B����ҵ����ʯ�����úȼ�պ��γɵ��������������������Ƶ�ʯ��
C��Ϊ����Ч�ķ�չ�����Դ�����õ��ˮ�ķ��������Ʊ�H2
D������ͣ������װ�������ʩ���ɽ�����β����CO��NOx��Ӧ����������
E�����û�ѧ��Ӧԭ������ƺ������µ�ҩ��
��II����14�֣�
��嫵ĺ�����һ�������Դ���⣬�̲��ŷ��ĵĿ�����DZ���Ļ�ѧ��Դ����ͼ�Ǻ�ˮ�ӹ���ʾ��ͼ��������ͼ�ش����⡣

��1����ˮ��������ͨ�����õ��Ʊ���ˮ�ķ����� ��д�����֣���
��2����ͼ�Ǵ�Ũ����ˮ����ȡ�������ͼ��д����ͼ�Т٢ڵĻ�ѧʽ���� ���� ���������з����Ļ�ѧ��Ӧ����ʽΪ ��

��3���Ʊ�����þ��ͨ��������ڵ�MgC12��������MgO����ԭ���� ��
��4��ʳ��Ҳ��һ����Ҫ�Ļ���ԭ�ϣ��ȼҵ����ͨ����ⱥ��ʳ��ˮ���Ʊ�NaOH��H2��C12����ˮ�еõ��Ĵ�������������һЩ���ʣ��������һЩ��ѧ�Լ���ʹ���ʳ��������������ˮ������������ӽ���������ԭ���� �����ʳ��ˮ�����ӽ���Ĥ�����н��У����ӽ���Ĥ�������� ��
��5���ྦྷ����Ҫ����SiHCl3��ԭ�����������丱����SiCl4��ת��ΪSiHCl3��ѭ��ʹ�á�һ�������£���20L�����ܱ������еķ�Ӧ��3
SiCl4��g��+2 H2��g��+Si��g�� 4
SiHCl3��g������ƽ���H2��SiHCl3���ʵ���Ũ�ȷֱ�Ϊ0.140mol/L��0.020mol/L����H2ȫ����Դ���ȼҵ�������������Ĵ�NaCl������Ϊ
kg��
4
SiHCl3��g������ƽ���H2��SiHCl3���ʵ���Ũ�ȷֱ�Ϊ0.140mol/L��0.020mol/L����H2ȫ����Դ���ȼҵ�������������Ĵ�NaCl������Ϊ
kg��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com