【答案】
分析:X的主要化合价是-2价,故X属于第ⅥA元素,X的原子半径为0.074nm,X为氧元素;
Y所在主族序数与所在周期序数之差为4,只有Cl元素符合,所以Y是氯元素;
Z原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰,所以Z是钾元素;
D最高价氧化物对应的水化物,能按1:1电离出电子数相等的阴、阳离子,说明D的最高价氧化物的水化物是碱,能按1:1电离出电子数相等的阴、阳离子,说明D是第ⅠA族的元素,该元素为常见元素,应为钠元素;
E其单质有多种同素异形体,一种为自然界中硬度最大,所以E是碳元素;
(1)根据离子结构示意图画出离子结构示意图;
(2)根据阴离子电子式的书写规则书写;
(3)亚硫酸根离子具有还原性,氯气具有氧化性,所以亚硫酸根离子和氯气能发生氧化还原反应;
(4)根据溶液中阴阳离子电荷守恒分析;
(5)根据平衡的移动判断平衡混合物中ZX
3含量最高的时间段,根据温度对化学平衡的影响判断平衡常数的大小.
解答:解:X的主要化合价是-2价,故X属于第ⅥA元素,X的原子半径为0.074nm,X为氧元素;
Y所在主族序数与所在周期序数之差为4,只有Cl元素符合,所以Y是氯元素;
Z原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰,所以Z是钾元素;
D最高价氧化物对应的水化物,能按1:1电离出电子数相等的阴、阳离子,说明D的最高价氧化物的水化物是碱,能按1:1电离出电子数相等的阴、阳离子,说明D是第ⅠA族的元素,该元素为常见元素,应为钠元素;
E其单质有多种同素异形体,一种为自然界中硬度最大,所以E是碳元素;
(1)氯原子得一个电子使最外层达到8个电子稳定结构,离子结构示意图为:

,故答案为:
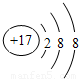
;
(2)书写阴离子电子式时,要用方括号括起来,写出电荷和电性,氢氧根离子的电子式为:
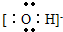
,故答案为:
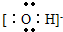
;
(3)亚硫酸根离子具有还原性,氯气有强氧化性,所以亚硫酸根离子和氯气能发生氧化还原反应生成盐酸和硫酸,
故答案为:SO
32-+Cl
2+H
2O=SO
42-+2Cl
-+2H
+;
(4)该溶液中存在的阴离子有碳酸根离子、碳酸氢根离子和氢氧根离子,阳离子有钠离子和氢离子,溶液中阴阳离子电荷守恒,得c(Na
+)+c(H
+)=2c(CO
32-)+c(HCO
3-)+c(OH
-),
故答案为:c(Na
+)+c(H
+)=2c(CO
32-)+c(HCO
3-)+c(OH
-);
(5)2ZX
2(g)+X
2(g)?2ZX
3(g)△H<0,该反应是反应前后气体体积减小的放热反应,
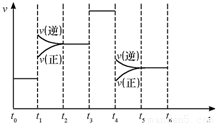
t
~t
1时间段,正逆反应速率相等,是化学平衡状态,平衡不移动;t
1~t
2时间段,逆反应速率降低,正反应速率增大,平衡向逆反应方向移动,生成物的浓度降低;t
2~t
3时间段,正逆反应速率相等,是化学平衡状态,平衡不移动;t
3~t
4时间段,正逆反应速率相等,是化学平衡状态,平衡不移动,但反应速率大于原来的反应速率,所以是向容器中加入了催化剂;t
4~t
5时间段,逆反应速率降低,正反应速率增大,平衡向逆反应方向移动,生成物的浓度减低;t
5~t
6时间段,正逆反应速率相等,是化学平衡状态,平衡不移动.所以表示平衡混合物中ZX
3含量最高的一段时间是t
~t
1;t
~t
1平衡常数为K
1,t
2~t
3平衡常数为K
2,t
~t
1与t
1~t
2相比,正逆反应速率都增大且不相等,可能是压强增大或温度升高,但t
1~t
2逆反应速率逐渐减小,正反应速率逐渐增大,平衡向逆反应方向移动,该反应是一个气体体积减小且放热的反应,所以只能是升高温度导致平衡向逆反应方向移动;t
2~t
3时间段,正逆反应速率相等,是化学平衡状态,平衡不移动,所以;t
1~t
2和t
2~t
3时间段温度相同,该反应是放热反应,升高温度,平衡向逆反应方向移动,导致生成物的浓度降低,反应物的浓度升高,所以平衡常数减小,所以K
1大于 K
2.
故答案为:t
~t
1;大于.
点评:本题考查了元素的判断、离子结构示意图的书写、电子式的书写、氧化还原反应等知识点,难度不大,会根据外界条件对化学平衡的影响来分析图象是解(5)题的关键.

 ,故答案为:
,故答案为: ;
;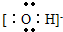 ,故答案为:
,故答案为: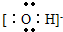 ;
;




 有关元素X、Y、Z、D、E的信息如下
有关元素X、Y、Z、D、E的信息如下
