
 2NO△H=+180kJ/mol,其中N≡N,O=O键的键能分别是946kJ/mol、498kJ/mol,则NO中化学键的键能为( )
2NO△H=+180kJ/mol,其中N≡N,O=O键的键能分别是946kJ/mol、498kJ/mol,则NO中化学键的键能为( )科目:高中化学 来源: 题型:阅读理解
| 化学键 | H-H | N-H | N≡N | 键能/kJ?mol-1 | 436 | 391 | 946 |
查看答案和解析>>
科目:高中化学 来源: 题型:

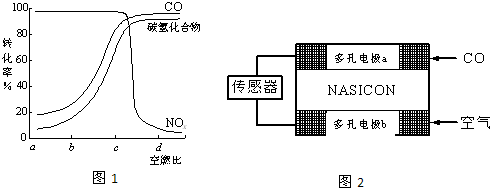
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 | 2 |
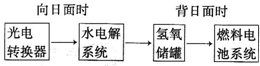
查看答案和解析>>
科目:高中化学 来源: 题型:
大气固氮属于自然固氮,合成氨是目前人工固氮的主要方法。科学家一直致
力“人工固氮”新方法的研究。
(1)有关大气固氮(以N2+O2![]() 2NO为例)、人工固氮(以为N2+3H2
2NO为例)、人工固氮(以为N2+3H2![]() 2NH3 为例)反应的平衡常数
2NH3 为例)反应的平衡常数![]() 的值如下表。
的值如下表。
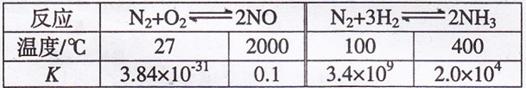
下列说法正确的是 填字母
a.大气固氮与人工固氮都是放热反应 b.人类模拟大气固氮无现实意义
c.寻找在常温下合成氨的高效催化剂是目前人工固氮的新方向
d.在常温下,人工固氮非常容易进行
(2)已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4KJ.mol-1
2NH3(g) △H=-92.4KJ.mol-1
2H2(g) + O2(g) = 2H2O(l) △H=-571.6KJ.mol-1
据报道,在常温、常压、光照、催化剂的条件下,![]() 可以与水反应,则反应
可以与水反应,则反应
N2(g) + 3H2O(l)= 2NH3(g) +3/2O2(g)的 △H= KJ.mol-1
(3)某研究小组在673 K、30 MPa下,在体积为VL的密闭容器中进行反应:,N2(g)+3H2(g)![]() 2NH3(g)其n(H2)和n(NH3)随时间变化的关系如图所示。
2NH3(g)其n(H2)和n(NH3)随时间变化的关系如图所示。
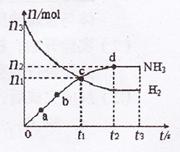
①下列叙述正确的是 填字母
A.点a的正反应速率比点b的大
B.点c处反应达到化学平衡状态
C.若如时由673 K升至773 K,则n(H2)将增大
②从开始到平衡时反应的平均速率(以H2的浓度变化表示)v(H2)= .
③若开始时n(N2)= n(H2),则反应的平衡常数K= (用代数式表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com