(2009?湘潭一模)如图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞).
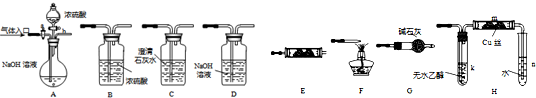
(1)若气体入口通入CO和CO
2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为
ACBECF
ACBECF
(填装置代号).能验证CO氧化产物的现象是
AB之间的C装置中溶液保持澄清,EF之间的C装置中溶液变浑浊
AB之间的C装置中溶液保持澄清,EF之间的C装置中溶液变浑浊
.
(2)停止CO和CO
2混合气体的通入,E内放置Na
2O
2,按A→E→D→B→H装置顺序制取纯净干燥的O
2,并用O
2氧化乙醇.此时,活塞a应
关闭
关闭
,活塞b应
打开
打开
,需要加热的仪器装置有
k、m
k、m
(填仪器代号),m中反应的化学方程式为
.
(3)若气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E内放置铂铑合金网,按A→G→E→D装置顺序制取干燥氨气,并验证氨的某些性质.
①装置A中能产生氨气的原因有:
氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氢氧化钠吸水,促使氨放出;氢氧化钠电离出的OH-增大了OH-浓度,促使氨水电离平衡左移,导致氨气放出
氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氢氧化钠吸水,促使氨放出;氢氧化钠电离出的OH-增大了OH-浓度,促使氨水电离平衡左移,导致氨气放出
.
②实验中观察到E内有红棕色气体出现,证明氨气具有
还原
还原
性.




 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案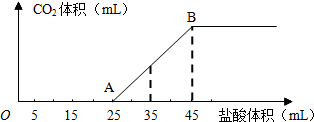 (2009?湘潭一模)将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol?L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
(2009?湘潭一模)将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol?L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示: