(2010?上海)胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(Mg
2Si
3O
8.nH
2O)等化合物.
1)三硅酸镁的氧化物形式为
2MgO.3SiO2.nH2O
2MgO.3SiO2.nH2O
,某元素与镁元素不同周期但在相邻一族,且性质和镁元素十分相似,该元素原子核外电子排布式为
1s22s1
1s22s1
.
2)铝元素的原子核外共有
13
13
种不同运动状态的电子、
5
5
种不同能级的电子.
3)某元素与铝元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半径
大
大
(填“大”或“小”),该元素与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:
Al(OH)3+OH-═AlO2-+2H2O
Al(OH)3+OH-═AlO2-+2H2O
4)Al
2O
3、MgO和SiO
2都可以制耐火材料,其原因是
ad
ad
.
a.Al
2O
3、MgO和SiO
2都不溶于水
b.Al
2O
3、MgO和SiO
2都是白色固体
c.Al
2O
3、MgO和SiO
2都是氧化物
d.Al
2O
3、MgO和SiO
2都有很高的熔点.

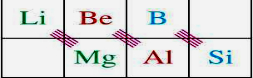 ,由此可推出与镁性质相似的元素,根据构造原理写出该元素原子的电子排布式;
,由此可推出与镁性质相似的元素,根据构造原理写出该元素原子的电子排布式;

 53随堂测系列答案
53随堂测系列答案