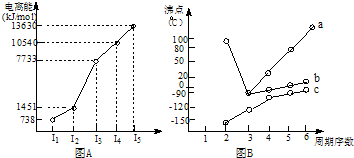
(2008?肇庆二模)重铬酸钾(K
2Cr
2O
7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO?Cr
2O
3)为原料生产.实验室模拟工业生产如图,涉及的主要反应有:6FeO?Cr
2O
3+24NaOH+7KClO
3 12Na
2CrO
4+3Fe
2O
3+7KCl+12H
2O.
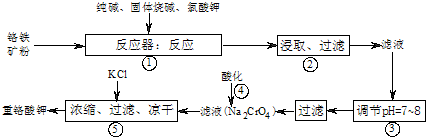
(1)在反应器中,有Na
2CrO
4生成,同时Fe
2O
3转变为NaFeO
2,杂质SiO
2.Al
2O
3与纯碱反应转变为可溶性盐,写出二氧化硅.氧化铝分别与碳酸钠反应其中一个的化学方程式:
SiO
2+Na
2CO
3Na
2SiO
3+CO
2↑
或Al
2O
3+Na
2CO
32NaAlO
2+CO
2↑
SiO
2+Na
2CO
3Na
2SiO
3+CO
2↑
或Al
2O
3+Na
2CO
32NaAlO
2+CO
2↑
.
(2)NaFeO
2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:
NaFeO2+2H2O=Fe(OH)3↓+NaOH
NaFeO2+2H2O=Fe(OH)3↓+NaOH
.
(3)操作③的目的是(用简要的文字和化学方程式说明):
由于溶液在硅酸钠和偏铝酸钠发生水解,SiO32-+H2O?HSiO3-+OH-.HSiO3-+H2O?H2SiO3+OH-.AlO2-+H2O?Al(OH)3+OH-,降低pH值有利于平衡向正反应方向移动;当pH调到7~8时它们水解完全
由于溶液在硅酸钠和偏铝酸钠发生水解,SiO32-+H2O?HSiO3-+OH-.HSiO3-+H2O?H2SiO3+OH-.AlO2-+H2O?Al(OH)3+OH-,降低pH值有利于平衡向正反应方向移动;当pH调到7~8时它们水解完全
.
(4)操作④中,酸化时,CrO
42-转化为Cr
2O
72-,写出平衡转化的离子方程式:
2CrO42-+2H+?Cr2O72-+H2O
2CrO42-+2H+?Cr2O72-+H2O
.
(5)称取重铬酸钾试样m g配成VmL溶液,取出V
1 mL于碘量瓶中,加入适量的稀H
2SO
4和足量碘化钾(铬的还原产物为Cr
3+),放于暗处5min,然后加入100mL水和3mL淀粉作指示剂,用c mol/LNa
2S
2O
3标准溶液滴定(相关反应为:
Cr
2O
72-+6I
-+14H
+═2Cr
3++3I
2+7H
2O.I
2+2S
2O
32-=2I
-+S
4O
62-,K
2Cr
2O
7式量为294.则:
①滴定时用到的玻璃仪器有(写仪器名称)
酸式滴定管、锥形瓶
酸式滴定管、锥形瓶
.
②判断达到滴定终点的依据是:
当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去且半分钟内不复现
当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去且半分钟内不复现
;
③设整个过程中其它杂质不参与反应.若实验中共用去Na
2S
2O
3标准溶液V
2mL,则计算所得产品的中重铬酸钾的纯度的代数式为(不必化简)
.

 和
和 ;“双烯合成反应”又称为“Diels-Alder反应”,如:
;“双烯合成反应”又称为“Diels-Alder反应”,如: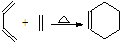 .
. ,则物质A的结构式为:
,则物质A的结构式为: 或CH2=CH-COOH
或CH2=CH-COOH 或CH2=CH-COOH
或CH2=CH-COOH

 中,D物质可发生反应生成一种生活中常用高分子,其化学方程式为:
中,D物质可发生反应生成一种生活中常用高分子,其化学方程式为:



 和
和 都是无色液体,下列物质中可以用来鉴别这两种物质的是
都是无色液体,下列物质中可以用来鉴别这两种物质的是 含C=C,能使溴水褪色,而
含C=C,能使溴水褪色,而 不能;
不能; 或CH2=CH-COOH;B与乙醇共热生成酯,B脱去-OH,乙醇脱H,该反应的化学方程式为
或CH2=CH-COOH;B与乙醇共热生成酯,B脱去-OH,乙醇脱H,该反应的化学方程式为 ,
, 或CH2=CH-COOH;
或CH2=CH-COOH; ;
; ,物质E与过量的H2发生加成反应,生成物中含2个环己烷结构,加成反应的生成物为
,物质E与过量的H2发生加成反应,生成物中含2个环己烷结构,加成反应的生成物为 ,故答案为:
,故答案为: ;
; ;
; 含C=C,能使溴水褪色,而
含C=C,能使溴水褪色,而 不能,则利用溴水可以鉴别,与银氨溶液、淀粉均不反应,与高锰酸钾均反应,故答案为:③;
不能,则利用溴水可以鉴别,与银氨溶液、淀粉均不反应,与高锰酸钾均反应,故答案为:③;

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案