
【题目】(1)第四周期中,未成对电子数最多的元素是________,(填名称)它位于第________族;核外电子排布式是__________________。它有________种运动状态不同的电子,其价电子排布图为:______________。
(2)已知NH5为离子化合物,写出其电子式:________。
(3)某同学根据掌握的知识分析Mg的核外电子排布为![]() 。该同学所画的电子排布图违背了________。
。该同学所画的电子排布图违背了________。
(4)在基态 14C原子中,核外存在________对自旋相反的电子。
【答案】铬 ⅥB 1s22s22p63s23p63d54s1或[Ar]3d54s1 24 ![]()
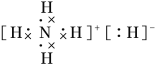 能量最低原理 2对
能量最低原理 2对
【解析】
(1)第四周期中未成对电子数最多的冤死,其核外电子排布式为1s22s22p63s23p63d54s1,有6个未成对电子,为24号元素,其名称是铬,位于第ⅥB族;在原子中,每一个电子的运动状态都是不一样的,铬原子核外有24个电子,因此它有24种运动状态不同的电子,其价电子排布图为:![]() ;
;
(2)NH5为离子化合物,由NH4+和H-构成,则其电子式为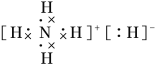 ;
;
(3)电子填充时,先填充能量较低的能级,3s能级的能量低于3p能量,因此电子应先填满3s能级,再填充3p能级,3s能级中应该有2个电子,而3p能级中没有电子,违反了能量最低原理;
(4)基态14C原子的核外电子排布图为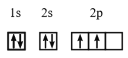 ,核外存在2对自旋相反的电子。
,核外存在2对自旋相反的电子。


科目:高中化学 来源: 题型:
【题目】实验室制备硫酸亚铁晶体步骤如下:取洁净铁屑于烧杯中,加入一定量的稀硫酸,在50℃水浴中加热一段时间,趁热过滤,滤液转移至锥形瓶中,置于冰水浴中冷却,经一系列操作后获得产品。下列说法不正确的是( )
A.反应过程中烧杯底部一般保留少量铁屑以提高产品纯度
B.硫酸溶液浓度过低会降低晶体产率
C.水浴加热可以加快反应速率同时避免生成的![]() 发生爆炸
发生爆炸
D.与室温冷却相比,冰水浴冷却滤液可以更快获得更多更大的晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的同素异形体有很多,我国科学家成功地合成了通过理论计算预言的T-碳。回答下列问题:
(1)基态碳原子价层电子的轨道表达式(电子排布图)为________。
(2)石墨炔可由六炔基苯![]() 在铜片的催化作用下发生偶联反应得到。
在铜片的催化作用下发生偶联反应得到。
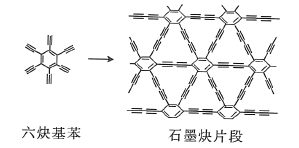
六炔基苯分子中的所有原子________(填“能”或“不能”)处于同一平面,六炔基苯属于________(填“极性”或“非极性”)分子,1个六炔基苯分子中含有![]() 键的数目为________。
键的数目为________。
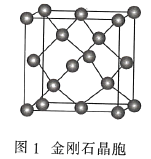
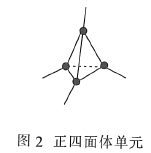
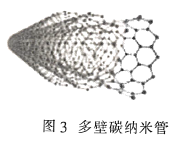
(3)金刚石(图1)中的每个碳原子用一个由4个碳原子组成的正四面体的结构单元(图2)取代,即得到T-碳。T-碳可通过皮秒激光照射悬浮在甲醇溶液中的多壁碳纳米管(图3)制得。多壁碳纳米管和T-碳中碳原子的杂化方式依次为________、________;溶剂甲醇中三种元素的电负性由大到小的顺序为________(用元素符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知辉铜矿、软锰矿的主要成分如下表所示:
矿石 | 辉铜矿 | 软锰矿 |
主要成分 | Cu2S、Fe2O3、SiO2 | MnO2、SiO2 |
某化工厂拟以这两种矿石为原料采用湿法冶炼铜,工艺如下:
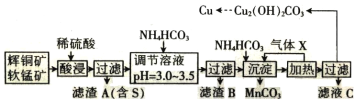
回答下列问题:
(1)气体 X 遇浓硝酸产生“白烟”,写出气体 X 的电子式:______________________________。
(2)提高“酸浸”速率的措施有______________________________(填两条)。
(3)用离子方程式表示“酸浸”中 MnO2 的作用:______________________________,被氧化的元素是______________________________(填元素符号)。
(4)已知 CH3COONH4 溶液呈中性,则常温下,NH4HCO3 溶液 pH______________________________(填“>”、“<”或“=”)7,理由是__________。
(5)从滤液 C 中可以提取一种化学肥料,它的化学式为_____________________________。
(6) 从溶液中析出的碱式碳酸铜可能带有结晶水,设其通式为 Cu2(OH)2CO3·xH2O。准确称取a g 样品,灼烧至恒重,称得 CuO 的质量,固体质量减轻 b g,则 x 为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯:![]()
![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.可用酸性高锰酸钾溶液鉴别乙苯和苯乙烯
B.苯乙烯能使溴水褪色,是因为两者发生了加成反应
C.乙苯和苯乙烯苯环上的一氯代物均为3种
D.乙苯和苯乙烯分子内共平面的碳原子数最多均为7个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素![]() 、
、![]() 、
、![]() 在周期表中的相对位置如图所示。已知
在周期表中的相对位置如图所示。已知![]() 元素原子的外围电子排布式为
元素原子的外围电子排布式为![]() ,则下列说法不正确的是( )
,则下列说法不正确的是( )
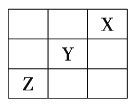
A.![]() 元素原子的价电子排布式为
元素原子的价电子排布式为![]()
B.![]() 元素在元素周期表的第三周期第ⅥA族
元素在元素周期表的第三周期第ⅥA族
C.![]() 元素所在周期中所含非金属元素最多
元素所在周期中所含非金属元素最多
D.![]() 元素原子的核外电子排布式为
元素原子的核外电子排布式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸合铁酸钾晶体Kx[Fe(C2O4)y]·3H2O是一种光敏材料,下面是一种制备草酸合铁酸钾晶体的实验流程。
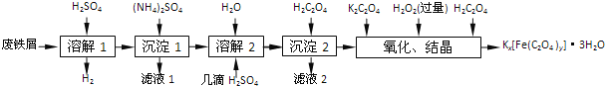
已知:(NH4)2SO4、FeSO4·7H2O、莫尔盐[(NH4)2SO4·FeSO4·6H2O]的溶解度如表:
温度/℃ | 10 | 20 | 30 | 40 | 50 |
(NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
FeSO4·7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | ― |
(NH4)2SO4·FeSO4·6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(1)废铁屑在进行“溶解1”前,需用在5% Na2CO3溶液中加热数分钟,并洗涤干净。Na2CO3溶液的作用是________。
(2)“溶解1”应保证铁屑稍过量,其目的是___________。“溶解2”加“几滴H2SO4”的作用是________。
(3)“复分解”制备莫尔盐晶体的基本实验步骤是:蒸发浓缩、________、过滤、用乙醇洗涤、干燥。用乙醇洗涤的目的是____________。
(4)“沉淀”时得到的FeC2O4·2H2O沉淀需用水洗涤干净。检验沉淀是否洗涤干净的方法是_______。
(5)“结晶”应将溶液放在黑暗处等待晶体的析出,这样操作的原因是__________。
(6)请补全测定草酸合铁酸钾产品中Fe3+含量的实验步骤[备选试剂:KMnO4溶液、锌粉、铁粉、NaOH溶液:
步骤1:准确称取所制备的草酸合铁酸钾晶体a g,配成250 mL待测液。
步骤2:用移液管移取25.00 mL待测液于锥形瓶中,加入稀H2SO4酸化,_________,C2O42-转化为CO2被除去。
步骤3:向步骤2所得溶液中______________。
步骤4:用c mol·L-1 KMnO4标准溶液滴定步骤3所得溶液至终点,消耗V mL KMnO4标准溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2、碳酸盐、有机物等均是自然界碳循环中的重要物质。回答下列问题:
(1)下列物质属于化合物但不属于电解质的是______(填字母)。
A.石墨 B.汽油 C.乙醇 D.碳酸
(2)倍半碳酸钠(Na2CO3·NaHCO3·2H2O)在水溶液中的电离方程式为__________________________。
(3)金属钠在足量CO2中燃烧生成常见的盐和单质,写出反应的化学方程式:____________。
(4)铜器表面的难溶物Cu2(OH)2CO3可用稀硫酸洗涤除去,该反应的离子方程式为________________。
(5)工业上制取金刚砂的反应为: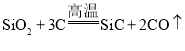 ,该反应中氧化剂与还原剂的物质的量之比为______。
,该反应中氧化剂与还原剂的物质的量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应: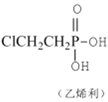 +4NaOH→NaCl+CH2=CH2↑+Na3PO4+3H2O。可用如图装置和给定的试剂制取1,2-二溴乙烷(其信息如下:相对分子质量为188、无色液体,密度2.18gcm-3,熔、沸点分别为9.79℃、131.4℃,不溶于水)。试管d中装有液溴(表面覆盖少量水)。回答下列问题:
+4NaOH→NaCl+CH2=CH2↑+Na3PO4+3H2O。可用如图装置和给定的试剂制取1,2-二溴乙烷(其信息如下:相对分子质量为188、无色液体,密度2.18gcm-3,熔、沸点分别为9.79℃、131.4℃,不溶于水)。试管d中装有液溴(表面覆盖少量水)。回答下列问题:
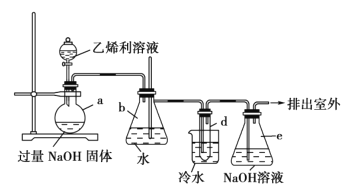
(1)仪器b的名称为______;其中长玻璃导管的作用是______。
(2)e装置的作用是______;其中所发生反应的离子方程式为______。
(3)试管d中发生反应的化学方程式为______。若用冰水代替烧杯中的冷水,可能引起的不安全后果是______。
(4)实验消耗40%乙烯利(摩尔质量为Mg·mol-1)溶液50g,制得产品mg,则乙烯利合成1,2-二溴乙烷的产率为______(用含M、m的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com