
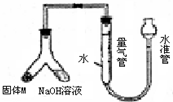
 某课外兴趣小组为探究某种铝合金(含Mg Al)中铝含量,设计如图装置进行实验.
某课外兴趣小组为探究某种铝合金(含Mg Al)中铝含量,设计如图装置进行实验.
| ||
| 3 |
| 0.018g |
| 0.036g |


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
 某课外兴趣小组为探究某种铝合金(合金元素为Mg Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计右图装置进行实验.
某课外兴趣小组为探究某种铝合金(合金元素为Mg Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计右图装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:
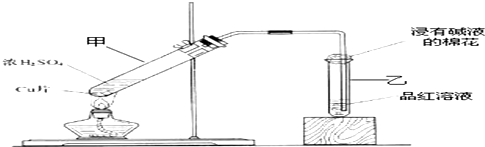 某课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了右图所示装置进行有关实验:
某课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了右图所示装置进行有关实验:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2013届山东省济宁市鱼台一中高三上学期期中考试化学试卷(带解析) 题型:实验题
(12分)某课外兴趣小组为探究某种铝合金(含Mg Al)中铝含量,设计如图装置进行实验。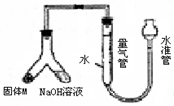
(1)如何检验该装置的气密性
(2)样品与氢氧化钠溶液反应的离子方程式: 。
(3)使足量氢氧化钠溶液与ag合金(固体M)充分反应,进入量气管的气体体积为VmL
(已换算成标准状况,下同)。若a=0.036,V=22.4,该合金中铝的质量分数是 。
(4)若将装置中的氢氧化钠替换为足量的盐酸,与ag合金粉末充分反应,则进入量气管内的气体体积 (填“>”“<”“=”)VmL;利用此方法测得的气体体积能否进行铝的含量计算? (填“能”或“否”)
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省济宁市高三上学期期中考试化学试卷(解析版) 题型:实验题
(12分)某课外兴趣小组为探究某种铝合金(含Mg Al)中铝含量,设计如图装置进行实验。
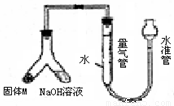
(1)如何检验该装置的气密性
(2)样品与氢氧化钠溶液反应的离子方程式: 。
(3)使足量氢氧化钠溶液与ag合金(固体M)充分反应,进入量气管的气体体积为VmL
(已换算成标准状况,下同)。若a=0.036,V=22.4,该合金中铝的质量分数是 。
(4)若将装置中的氢氧化钠替换为足量的盐酸,与ag合金粉末充分反应,则进入量气管内的气体体积 (填“>”“<”“=”)VmL;利用此方法测得的气体体积能否进行铝的含量计算? (填“能”或“否”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com