
【题目】一定条件下向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体,图 1 表示各物质浓度随时间的变化,图 2 表示速率随时间的变化,t2、t3、t4、t5 时刻各改变一种条件,且改变的条件均不同。若t4时刻 改变的条件是压强,则下列说法错误的是

A.若 t1=15 s,则前 15 s 的平均反应速率 v(C)=0.004 mol·L-1·s-1
B.该反应的化学方程式为 3A(g)![]() B(g)+2C(g)
B(g)+2C(g)
C.t2、t3、t5 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度
D.若 t1=15 s,则 B 的起始物质的量为 0.04 mol
【答案】C
【解析】
A. 反应在t1时刻达到平衡时,气体C的浓度增大0.06mol·L-1,所以平均反应速率为v(C)= ![]() =0.004 mol·L-1·s-1,故A正确;
=0.004 mol·L-1·s-1,故A正确;
B. t4时刻降低压强后反应平衡状态没有改变,说明反应物系数和与生成物系数和相等,又因为反应第一次达到平衡时气体A浓度降低0.09mol·L-1,气体C的浓度增大0.06 mol·L-1,所以气体A与C的系数比为3:2,因此气体B也是生成物且其系数为1,所以化学方程式为3A(g)B(g)+2C(g),故B正确;
C. t5时刻后若为增大反应物浓度,开始时应该只有正反应速率增大,不会两个反应速率同时增大,故C错误;
D. 气体C的浓度增大0.06mol·L-1,气体B、C的反应系数比为1:2,所以气体B浓度增大0.03mol·L-1,又由初始气体A浓度可知,容器的体积为0.3mol/0.15molL1=2L,可知气体B起始物质的量为(0.05-0.03)mol·L-1×2L=0.04mol,故D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】铋为第五周期VA族元素,利用湿法冶金从辉铋矿(含Bi2S3、Bi、Bi2O3等)提取金属铋的工艺流程如下图所示:
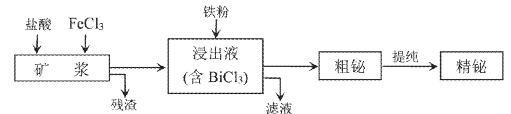
已知:BiCl3水解的离子方程式为:BiCl3+H2O![]() BiOCl+2H++2Cl-。
BiOCl+2H++2Cl-。
(1)矿浆浸出时加入盐酸的作用是___________。
(2)浸出时,Bi溶于FeCl3溶液的化学方程式为___________。
(3)残渣中含有一种单质,该单质是___________。
(4)滤液的主要溶质是(化学式)___________,该物质可在工艺中转化为循环利用的原料,转化的反应方程式为___________。
(5)精辉铋矿中含有Ag2S,被氧化溶解后不会进入浸出液,银元素以___________(填化学式)进入残渣中。
(6)粗铋提纯时,粗铋应放在___________极,阴极的电极反应式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关化学反应的判断下列说法中正确的是
A. 常温下,放热反应一般都能自发进行.而吸热反应都不能自发进行
B. 反应NH4HCO3(s)![]() NH3(g)+H2O(g)+CO2(g) ΔH= +185.57 kJ· mol-1,在低温条件下不自发,但在高温条件下能自发
NH3(g)+H2O(g)+CO2(g) ΔH= +185.57 kJ· mol-1,在低温条件下不自发,但在高温条件下能自发
C. 自发反应一定都能发生,而非自发发应在任何条件下都不能发生
D. 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学工作者研发了一种SUNCAT的系统,借助锂循环可持续合成氨,其原理如下图所示。下列说法不正确的是

A. 过程Ⅰ得到的Li3N中N元素为-3价
B. 过程Ⅱ生成W的反应:Li3N+3H2O===3LiOH+NH3↑
C. 过程Ⅲ中能量转化的形式:化学能转变为电能
D. 过程Ⅲ涉及到反应:4OH-4 e-=== O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项属于油脂的用途的是( )
①作人类的营养物质 ②制取甘油 ③制取肥皂 ④制备高级脂肪酸 ⑤制备矿物油
A.仅①②③④B.仅①③⑤CC.仅①②④⑤D.仅①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L、体积分别为Va和Vb的HA溶液与BOH 溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH 的关系如图所示。下列说法正确的是
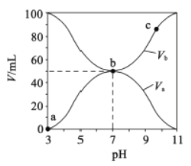
A. 由图可知BOH 一定是强碱 B. Ka(HA)=1×10-6mol/L
C. b点时,c(B-)=c(A-)=c(OH-)=c(H+) D. a→b过程中水的电离程度始终增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】澳大利亚研究人员开发出被称为第五形态的固体碳,这种新的碳结构称作纳米泡沫,它外形类似海绵,密度极小,并且有磁性。纳米泡沫碳与金刚石的关系是( )
A.同素异形体B.同分异构体
C.同位素D.同一物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g)在温度为T1、T2(T1<T2)时达到平衡,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g)在温度为T1、T2(T1<T2)时达到平衡,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是

A. A、C两点的反应速率:A>C
B. B、C两点的气体的平均相对分子质量:B<C
C. A、C两点气体的颜色:A浅,C深
D. 保持容器体积不变,再充入NO2气体,NO2的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理利用或转化NO2、SO2、CO、NO等污染性气体是人们共同关注的课题。
Ⅰ.某化学课外小组查阅资料后得知:2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
②N2O2(g)+O2(g)![]() 2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
请回答下列问题:

(1)反应2NO(g)+O2(g)![]() 2NO2(g)的H=________________(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的H=________________(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
(2)决定2NO(g)+O2(g)![]() 2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
Ⅱ.(3)反应N2O4(g)![]() 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
(4)在25℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1 HCl溶液等体积混合后溶液恰好呈中性(忽略溶液混合后体积的变化),用含a的表达式表示250C时NH3·H2O的电离常数Kb=_________________。用质量分数为17%,密度为0.93 g/cm3的氨水,配制200 mL a mol·L-1的氨水溶液,所需原氨水的体积V=___________mL。
(5)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为_________,阴极的电极反应式是__________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com