
I .如下图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰.现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答以下问题.
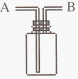
(1) 选用A装置可制取的气体有 ,选用B装置可制取的气有 ,
通常选用C装置制取的气体有 。
(2) 写出利用上述有关药品制取氨气的化学方程式: 。
若要制得干燥的氨气,可选用下列干燥剂中的 (填序号)
a. 生石灰 b. 浓硫酸 C. 五氧化二磷 d. .碱石灰
II. (3) 实验室制取的一氧化氮气体利用右图装置选用必要试剂如何进行收集?
。
III.(4) 现安装一套实验室利用液一液反应制备气体的装置。有人设计了五步操作,请你安排出正确而简捷的程序,将序号填入括号内。
( )将蒸馏烧瓶固定在铁架台上。
( )把酒精灯放在铁架台上,根据酒精灯确定铁圈的高度,固定铁圈,放好石棉网。
( )用漏斗向蒸馏烧瓶中加入一种液体反应物,再向分液漏斗中加入另一种液体反应物,并将导气管放入气体收集器中。
( )检查装置的气密性(利用对固定装置进行微热的方法来检查气密性,假定瓶口漏气而需要更换橡皮塞)。
( )在蒸馏烧瓶上装好分液漏斗,连接好导气管。
科目:高中化学 来源: 题型:阅读理解
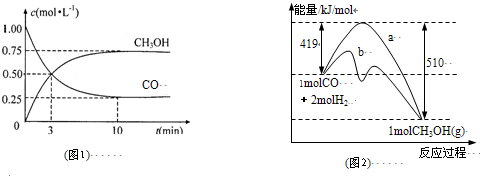
| c(CH3OH) |
| c(CO)×c2(H2) |
| c(CH3OH) |
| c(CO)×c2(H2) |
| n(CH3OH) |
| n(CO) |

查看答案和解析>>
科目:高中化学 来源: 题型:
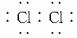
请完成下列问题:
(1)E的电子式为____________________,J的化学式为_____________________。
(2)写出K溶液与Y反应的离子方程式____________________________________________。
(3)写出D溶液与X反应的离子方程式_________________________________________。
(4)写出A+B![]() C+E的化学方程式______________________________________。
C+E的化学方程式______________________________________。
(5)如果n(A)∶n(B)=6∶1,则B可能的化学式____________。
查看答案和解析>>
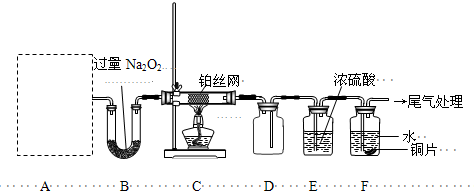
科目:高中化学 来源: 题型:

(1)X的化学式为__________________,O的结构简式为__________________。
(2)考虑到综合经济效益,工业生产M时,可采取的措施有__________________(填序号)。
a.使用催化剂 b.适当降低温度
c.选择合适的温度 d.适度增大压强
e.及时分离出产物 f.对原料进行循环利用
g.充分利用反应本身放出的热量 h.工厂地址尽可能选择在交通发达的城市
i.工厂地址可选择在盛产天然气的地区
(3)设备I的名称__________。工业生产中为了节约资源、降低成本和保护环境,常常对某些物质进行循环利用。上述转化关系中能达到该目的的是__________(填序号)。
(4)现有1 mol A参加反应,假设各步均完全反应,生成N的质量为
查看答案和解析>>
科目:高中化学 来源:2012-2013年江苏南京学大教育专修学校高二3月月考化学试卷(带解析) 题型:填空题
I、如下图所示,在容器A中装有20℃的水50 mL,容器B中装有1 mol/L的盐
酸50 mL,试管C、D相连通,且其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平
衡:2NO2?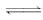 ?N2O4 ΔH=-57 kJ/mol,
?N2O4 ΔH=-57 kJ/mol,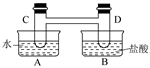
当向A中加入50 gNH4NO3晶体使之溶解;向B中加入2 g苛性钠时:
(1)C中的气体颜色__________; (填“变浅”或“变深”)。
(2)若25℃时,起始时仅有NO2气体,达到平衡时,c(NO2)=0.012 5 mol/L,c(N2O4)=
0.0321mol/L,则NO2的起始浓度为__________,NO2的转化率为__________。
Ⅱ. 在三支容积均为30cm3针筒中分别抽入10cm3NO2气体,将针筒前端封闭。
(1)将第二支针筒活塞迅速推至5cm3处,此时气体的颜色变深,一段时间后气体颜色又变浅了,但仍比第一支针筒气体的颜色深。
① 推进针筒后颜色变深的原因是 ;
②一段时间后气体颜色又变浅的原因是
③ 在此过程中,该反应的化学平衡常数将 (填“增大”、“减小”或“不变”,下同)NO2的转化率将 。
查看答案和解析>>
科目:高中化学 来源:2014届江苏南京学大教育专修学校高二3月月考化学试卷(解析版) 题型:填空题
I、如下图所示,在容器A中装有20℃的水50 mL,容器B中装有1 mol/L的盐
酸50 mL,试管C、D相连通,且其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平
衡:2NO2?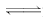 ?N2O4 ΔH=-57 kJ/mol,
?N2O4 ΔH=-57 kJ/mol,
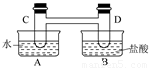
当向A中加入50 gNH4NO3晶体使之溶解;向B中加入2 g苛性钠时:
(1)C中的气体颜色__________; (填“变浅”或“变深”)。
(2)若25℃时,起始时仅有NO2气体,达到平衡时,c(NO2)=0.012 5 mol/L,c(N2O4)=
0.0321mol/L,则NO2的起始浓度为__________,NO2的转化率为__________。
Ⅱ. 在三支容积均为30cm3针筒中分别抽入10cm3NO2气体,将针筒前端封闭。
(1)将第二支针筒活塞迅速推至5cm3处,此时气体的颜色变深,一段时间后气体颜色又变浅了,但仍比第一支针筒气体的颜色深。
① 推进针筒后颜色变深的原因是 ;
②一段时间后气体颜色又变浅的原因是
③ 在此过程中,该反应的化学平衡常数将 (填“增大”、“减小”或“不变”,下同)NO2的转化率将 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com