
已知20℃时硝酸钾的溶解度是31.6克。在此温度下,将50克硝酸钾晶体倒入50毫升蒸馏水中,充分搅拌,所得溶液的溶质质量分数为( ):
A.50% B.76%
C.24% D.25%
科目:高中化学 来源: 题型:
(2008?闵行区模拟)一定质量的某硝酸钾样品中不含可溶性杂质,在10℃时加一定量蒸馏水使之充分溶解,残留固体的质量为250g,若升温至40℃,残留固体的质量为120g;升温至70℃,残留固体的质量为20g.已知KNO3在不同温度下的溶解度:
|
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省福州市高三毕业班质检(第一次)理综化学试卷(解析版) 题型:填空题
高铁酸钾(K2FeO4)有强氧化性,是一种安全性很高的水处理剂。
(1)高铁酸钾中铁元素的化合价是????? ,它可以将废水中的亚硝酸钾(KNO2)氧化,同时生成具有吸附性的Fe(OH)3,该反应的化学方程式为???????????????? 。
(2)某学习小组用废铁泥(主要成分为Fe3O3、FeO、CuO和少量Fe)制备高铁酸钾的流程如下:
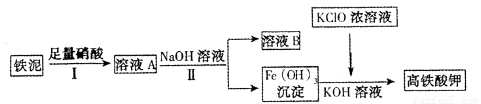
①操作Ⅰ要在通风橱中进行,其原因是??????????? 。
②溶液A中含有的金属阳离子是????????????? 。
③25℃时,若将溶液B中的金属离子完全沉淀,应调节c(H+)小于?????? 。(已知:i. Ksp[Fe(OH)3]=2.7×10-39、Ksp[Fe(OH)2] =4.0×10-17、Ksp[Cu(OH)2] =1.6×10-20;ii. 溶液中离子浓度小于10-5 mol·L-1时,可视为沉淀完全。)
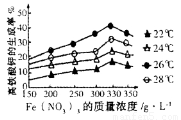
④该小组经多次实验,得到如图结果,他们的实验目的是???????????????? 。
(3)高铁酸钾还可以用电解法制取,电解池以铁丝网为阳极,电解液使用氢氧化钾溶液,其阳极反应式为??????????????? 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源:闵行区模拟 题型:单选题
| 温度(℃) | 10 | 40 | 55 | 70 |
| 溶解度(g/100g 水) | 20 | 65 | 100 | 140 |
| A.该硝酸钾样品一定为纯净物 |
| B.40℃时溶于水的硝酸钾为130g |
| C.70℃硝酸钾溶液为饱和溶液 |
| D.55℃左右时硝酸钾完全溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com