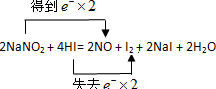
亚硝酸钠(NaNO2)又称工业盐,其外观类似食盐,但有剧毒.近年来,建筑工地多次发生民工误食工业盐而中毒的事件.利用如下反应可鉴别NaNO2和NaCl.
KMnO4+ NaNO2+ H2SO4= MnSO4+ K2SO4+ NaNO3+ H2O
(1)配平上述反应的化学方程式;
(2)指出该反应的氧化剂 ;
(3)当有2mol氧化剂被还原时,则转移的电子是 mol.
【答案】分析:(1)根据氧化还原反应中得失电子数相等进行配平.
(2)在氧化还原反应中得电子化合价降低的物质是氧化剂.
(3)根据氧化剂和转移电子之间的关系式计算转移电子数.
解答:解:(1)该反应中,1mol高锰酸钾参加氧化还原反应得到4mol电子,1mol亚硝酸钠参加氧化还原反应失去2mol电子,所以得失电子的最小公倍数是10,则高锰酸钾的计量数是2,亚硝酸钠的计量数是5,其它原子根据原子守恒配平即可,所以该反应方程式为:2 KMnO4+5 NaNO2+3 H2SO4=2 MnSO4+1 K2SO4+5 NaNO3+3 H2O.
故答案为:2;5;3;2;2;1;5;3.
(2)该反应中高锰酸钾得电子化合价降低,所以高锰酸钾是氧化剂.
故答案为:KMnO4.
(3)当有1mol高锰酸钾参加氧化还原反应时,转移5mol电子,所以当有2mol氧化剂被还原时,则转移的电子是10mol. 故答案为:10.
点评:本题考查了氧化还原反应的配平、氧化剂的判断等知识点,难度不大,根据氧化还原反应中得失电子相等来配平方程式即可.