
【题目】已知①Na2O2②O2③HClO④H2O2⑤Cl2⑥NaClO⑦O3七种物质都具有强氧化性。请回答下列问题:
(1)上述物质中互为同素异形体的是_____(填序号,下同)。
(2)含非极性键的共价化合物是_____。
(3)属于离子化合物的有_____种。
(4)Na2O2、HCIO、H2O2均能用于制备O2。
①HClO在光照条件下分解生成O2和HCl,用电子式表示HCl的形成过程_____。
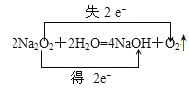
②写出Na2O2与H2O反应的方程式并标出电子转移方向和数目_____。
③H2O2在二氧化锰催化作用下可以制备O2。若6.8gH2O2参加反应,则转移电子数目为_____,生成标准状况下O2体积为_____L。
【答案】②⑦ ④ 2 ![]()
 1.204×1023或0.2NA 2.24
1.204×1023或0.2NA 2.24
【解析】
①Na2O2为离子化合物,含有离子键和非极性键;
②O2为非金属单质,只含有非极性键;
③HClO为共价化合物,含有极性键;
④H2O2为共价化合物,含有极性键和非极性键;
⑤Cl2为非金属单质,只含有非极性键;
⑥NaClO为离子化合物,含有离子键和极性键;
⑦O3为非金属单质,只含有非极性键;
(1)由同种元素组成的不同的单质互为同素异形体,O2与O3是氧元素形成的不同单质,互为同素异形体,故答案为:②⑦;
(2)由分析可知,含非极性键的共价化合物是H2O2,故答案为:④;
(3)由分析可知,七种物质中Na2O2和NaClO为离子化合物,共2种,故答案为:2;
(4)①HCl是共价化合物,用电子式表示HCl的形成过程是:![]() ,故答案为:
,故答案为:![]() ;
;
②Na2O2与H2O反应生成氧气和氢氧化钠,反应的化学方程式为2Na2O2 +2H2O=4NaOH +O2↑,反应中生成1mol氧气,转移2mol电子,电子转移方向和数目可表示为 ,故答案为:
,故答案为: ;
;
③在二氧化锰做催化剂作用下,双氧水分解生成水和氧气,反应的化学方程式为2H2O2![]() O2↑+2H2O,由方程式可知,生成1mol氧气转移2mol电子,6.8g H2O2的物质的量为
O2↑+2H2O,由方程式可知,生成1mol氧气转移2mol电子,6.8g H2O2的物质的量为![]() =0.2mol,则反应生成0.1mol氧气,转移的电子的数目为0.1mol×2×6.02×1023mol-1=1.204x1023或0.2NA,标准状况下O2体积为0.1mol×22.4L·mol 1=2.24L,故答案为:1.204x1023或0.2NA;2.24。
=0.2mol,则反应生成0.1mol氧气,转移的电子的数目为0.1mol×2×6.02×1023mol-1=1.204x1023或0.2NA,标准状况下O2体积为0.1mol×22.4L·mol 1=2.24L,故答案为:1.204x1023或0.2NA;2.24。


科目:高中化学 来源: 题型:
【题目】乙烯是重要有机化工原料。结合以下路线回答:

已知:2CH3CHO + O2催化剂,加热2CH3COOH
(1)反应①的化学方程式是_______。
(2)B的官能团是_______。
(3)F是一种高分子,可用于制作食品袋,其结构简式为_______。
(4)G是一种油状、有香味的物质,有以下两种制法。
制法一:实验室用D和E反应制取G,装置如图所示。

i.反应⑥的化学方程式是______,反应类型是_____。
ii.分离出试管乙中油状液体用到的主要仪器是_______。
制法二:工业上用CH2=CH2和E直接反应获得G。
iii.反应类型是___。
iv.与制法一相比,制法二的优点是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烷和乙烯都能制得一氯乙烷。
(1)由乙烷制一氯乙烷的化学方程式为____________,反应类型为______________。
(2)在催化剂作用下,由乙烯制一氯乙烷的化学方程式为____________,反应类型为______________。
(3)以上两种方法中_________[填“(1)”或“(2)”]更适合用来制取一氯乙烷,原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子晶体的数据大小比较不正确的是( )
A. 晶格能:NaF>NaCl>NaBr
B. 硬度:MgO>CaO>BaO
C. 熔点:NaF>MgF2>AlF3
D. 阴离子的配位数:CsCl>NaCl>CaF2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaCl2可用于电子、仪表等工业。以毒重石(主要成分为BaCO3,含少量的CaCO3、MgSO4、Fe2O3、SiO2等杂质)为原料,模拟工业制取BaCl2·2H2O的流程如下图所示:

已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9

(1)盐酸浸取时需要适当加热的原因是_________。
(2)用37%的盐酸配制15%的盐酸需用到的仪器有________(填字母)
A.量筒 B.烧杯 C.容量瓶 D.玻璃棒
(3)滤渣I的成分为__________;
(4)Mg(OH)2的溶度积常数Ksp=_______,加入H2C2O4时发生的离子反应为_______,加入H2C2O4应避免过量,其原因是_________。
(5)母液中除了含有Ba2+、Cl—外,还含有大量的_________(填离子符号);
(6)滤渣III(不含结晶水)是结石的主要成分滤渣Ⅲ经过洗涤干燥后在空气中进行热重分析,取128.0g该纯净物,在200~470℃灼烧,最后得到100.0g产物,200~470℃时发生反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标号为①~⑩的元素,在元素周期表中的位置如下:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
试回答下列问题:
(1)(填写元素符号)① _____③______⑤_____ ⑦_____
(2)①和④号元素形成的化合物的化学式________,用电子式表示其形成过程为__________。
(3)⑦和⑧号元素的最高价氧化物的水化物的碱性是: ______﹥_________ (填化学式)。⑨和⑩号元素的最高价氧化物的水化物的酸性是: ______ ﹥_________ (填化学式)。
(4)①、⑤、⑦号元素形成的一种化合物的电子式是________,在该化合物中既含有________键,又含有________键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去)。请回答:

(1)实验室制备氨气的化学方程式为__。
(2)在制取氨气后,如果要干燥氨气,可选用的干燥剂是__。
A.固体氢氧化钠
B.浓硫酸
C.氯化钙
D.五氧化二磷
E.碱石灰
(3)用装置B收集氨气时,氨气的进气口是___(填“a”或“b”)。
(4)待圆底烧瓶中收集满氨气后,关闭a、b,打开装置B中的止水夹c,一段时间后,若观察到烧瓶内产生了红色喷泉,则说明氨气具有的性质是:___、___。
(5)以下装置(盛放的液体均为水)可用于吸收多余氨气的是__(填序号)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com