
【题目】下列图示变化为吸热反应的是
A.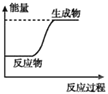
B.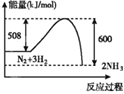
C.
D.
【答案】A
【解析】
反应物的总能量大于生成物的总能量的反应为放热反应,反应物的总能量小于生成物的总能量的反应为吸热反应。常见的放热反应有:燃烧、金属与酸反应、金属与水反应、酸碱中和反应、铝热反应和绝大多数化合反应等;常见的吸热反应有:绝大数分解反应、某些化合反应(如碳与二氧化碳的反应)、碳与水蒸气的反应、氯化铵晶体与Ba(OH)2·8H2O的反应等。
A.图中反应物的总能量较低生成物的总能量较高,则该反应为吸热反应,A正确;
B.图中反应物的总能量较高生成物的总能量较低,则该反应为放热反应,B错误;
C.浓硫酸溶于水放热,但过程中没有发生化学变化,不符合题意,C错误;
D.活泼金属与酸的反应是放热反应,不符合题意,D错误;
故选A。


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲测定室温下(25 ℃、101 kPa)的气体摩尔体积,请回答以下问题。该小组设计的简易实验装置如图所示:
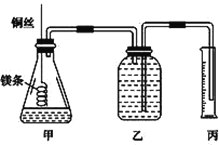
主要操作步骤如下:
①配制一定体积1.0 mol/L的盐酸溶液;
②量取10.0 mL 1.0 mol/L的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL。
请回答下列问题。
(1)为使HCl全部参加反应,a的数值至少为___________;若实验中至少需要220mL上述盐酸,配制该盐酸溶液需量取36.5% 1.18g/cm3的浓盐酸______mL。
(2)在配制溶液中,以下操作会使溶液浓度偏低的是_______(填序号)
A、在溶解过程中有少量液体溅出烧杯外 B、定容时仰视刻度线
C、量取浓盐酸时仰视刻度线 D、容量瓶洗净后没有干燥直接配制
(3)实验步骤⑤中应选用________(填序号)的量筒。
A.100 mL B.200 mL C.500 mL
(4)若忽略水蒸气的影响,读数时除恢复到室温外,还要注意_____________________。在实验条件下测得气体摩尔体积的计算式为Vm=________(用含V的表达式表示),若未除去镁条表面的氧化膜,则测量结果________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是制备液晶材料的中间体之一,其结构简式为![]() 。G的一种合成路线如下:
。G的一种合成路线如下:
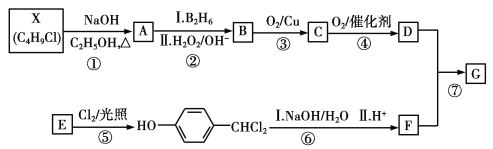
其中,A~F分别代表一种有机化合物,合成路线中的部分产物及反应条件已略去。
已知:①X的核磁共振氢谱只有1个峰;
②RCH=CH2 RCH2CH2OH;
RCH2CH2OH;
③通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
请回答下列问题:
(1)A的结构简式是_____;D中官能团的名称是______。
(2)B的名称是________;第①~⑦中属于取代反应的有_____(填步骤编号)。
(3)反应⑥的化学方程式是_______。
(4)G经催化氧化得到Y(C11H12O4),写出同时满足下列条件的Y的一种同分异构体的结构简式____
a.苯环上的一氯代物有2种;b.水解生成二元羧酸和醇。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)已知室温下CO的燃烧热为283kJ/mol,则CO的燃烧热的热化学方程式为____。
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为:CO(g)+2H2(g)![]() CH3OH(g) H=-116kJ/mol,如图①表示CO的平衡转化率(
CH3OH(g) H=-116kJ/mol,如图①表示CO的平衡转化率(![]() )随温度和压强变化的示意图中横坐标X表示的是_________,Y1______Y2(填“<”、“=”、“>”);
)随温度和压强变化的示意图中横坐标X表示的是_________,Y1______Y2(填“<”、“=”、“>”);
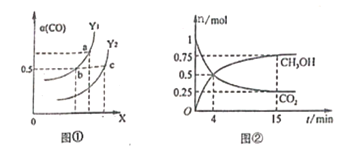
(3)合成甲醇的反应原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在0.5L的密闭器中,充入1 mol CO2和3molH2,在500℃下生反应,测得CO2(g和CH3OH(g)的量随时间变化如图②所示。
CH3OH(g)+H2O(g),在0.5L的密闭器中,充入1 mol CO2和3molH2,在500℃下生反应,测得CO2(g和CH3OH(g)的量随时间变化如图②所示。
①反应进行到4min时,v(正)____v(逆)(填“<”、“=”、“>”),0~4min,H2的平均反应速率v(H2)=_____________;
②该温度下平衡常数为_____________;
③下列能说明该反应已达到平衡状态的是___________;
A. v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1:3:1:1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
(4)为提高燃料的能量利用率,常将其设计为燃料电池。某电池以甲醇为燃料,空气为氧化剂,KOH溶液为电解质溶液,以具有催化作用和导电性能的稀土金属为电极写出该燃料电池的负极反应式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知①Na2O2②O2③HClO④H2O2⑤Cl2⑥NaClO⑦O3七种物质都具有强氧化性。请回答下列问题:
(1)上述物质中互为同素异形体的是_____(填序号,下同)。
(2)含非极性键的共价化合物是_____。
(3)属于离子化合物的有_____种。
(4)Na2O2、HCIO、H2O2均能用于制备O2。
①HClO在光照条件下分解生成O2和HCl,用电子式表示HCl的形成过程_____。
②写出Na2O2与H2O反应的方程式并标出电子转移方向和数目_____。
③H2O2在二氧化锰催化作用下可以制备O2。若6.8gH2O2参加反应,则转移电子数目为_____,生成标准状况下O2体积为_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表得第_____________族,其基态原子中未成对电子的个数为______。
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为________,所含非金属元素的第一电离能由大到小的顺序是_________。
(3)尿素分子中碳原子为________杂化,分子中σ键与π键的数目之比为_____。
(4)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=___。Fe(CO)x常温下呈液态,熔点为-20 .5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于_______(填晶体类型)。
(5)血红素是吡咯(C4H5N)的重要衍生物,血红素(含Fe2+)可用于治疗缺铁性贫血。吡咯和血红素的结构如图所示。
吡咯![]() 血红素
血红素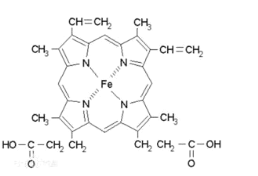
①1 mol吡咯分子中所含的σ键总数为____个。(用NA表示阿伏加德罗常数的值)分子中的大π键可用![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为____ 。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为____ 。
②血液中的O2是由血红素在人体内形成的血红蛋白来输送的,则血红蛋白中的Fe2+与O2是通过____键相结合。
③血红素中N的杂化方式为______________,请画出血红素中N与Fe的配位键_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有只含C、H、O的化合物A-F(相同官能团连接在不同碳原子上,A的一卤代物只有一种),有关它们的某些信息,已注明在下面的方框内:
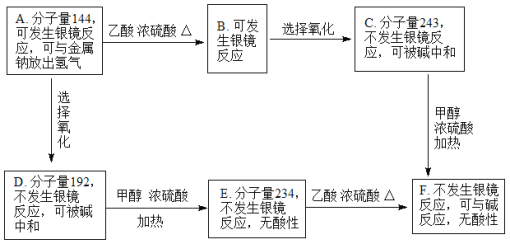
(1)在化合物A~F中,具酯基的化合物有_________个。
(2)A中含氧官能团的结构式为__________________、_______________________。
(3)1molA与足量新制氢氧化铜共热,可生成_________mol砖红色沉淀。
(4)写出F与过量的氢氧化钠溶液共热的化学方程式:___________________________________________。
(5)G是B的同分异构体,且G必须满足如下条件:
①G是芳香族化合物只有一种官能团
②1molG恰好能与3mol氢氧化钠溶液反应
③G分子中不含甲基,苯环上有4个取代基,且同一种官能团不连接在一个碳原子上。则满足条件的同分异构体有:________种。请任写两种:_________________________、___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】断肠草(Gelsemium)为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分离出来的四种毒素的结构式,下列推断正确的是

A. ①、②、③、④互为同分异构体
B. ①、③互为同系物
C. 等物质的量的②、④分别在足量氧气中完全燃烧,前者消耗氧气比后者少
D. ①、②、③、④均能与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl、CO32、SO42,现取三份各100mL溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生
②第二份加过量NaOH溶液加热后,只收集到气体0.02mol,最终无沉淀生成,同时得到溶液甲
③在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g
④第三份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g
下列说法不正确的是( )
A.原溶液中一定不存在的离子为Fe3+、Mg2+、CO32、Ba2+
B.c(SO42)=0.5mol/L
C.无法判断原溶液中是否存在Cl
D.无法判断原溶液中是否存在K+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com