
不能说明CH3COOH是弱酸的事实是
| A.醋酸钠溶液显碱性 |
B.10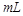 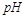 =2的醋酸溶液加水稀释到100 =2的醋酸溶液加水稀释到100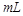 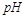 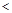 3 3 |
C.中和10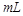 0.1 0.1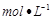 醋酸溶液,需要消耗0.1 醋酸溶液,需要消耗0.1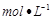 氢氧化钠溶液10 氢氧化钠溶液10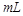 |
| D.0.1 mol·L-1的醋酸溶液中,氢离子浓度约为0.001 mol·L-1 |
C
解析试题分析:弱电解质的证明,是基于与强电解质对比进行的。弱电解质与强电解质最大的区别就是弱电解质存在电离平衡,而强电解质不存在电离平衡。因此只要证明有电离平衡存在,就证明了弱电解质。所以选项ABD均可以证明醋酸存在电离平衡。C中任何一元酸均消耗等量的氢氧化钠,不能证明,答案选C。
考点:考查醋酸是弱酸的实验探究
点评:该题是高考中的常见题型,试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,旨在培养学生的逻辑推理能力和抽象思维能力,提高学生的应试能力,调动学生的学习兴趣。该题的关键是明确弱电解质的电离平衡特点,然后灵活运用即可。


科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:



 CH3COOH+OH-
CH3COOH+OH- CH3COOH+OH-
CH3COOH+OH-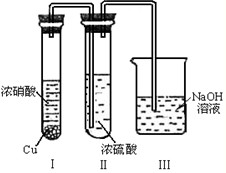
查看答案和解析>>
科目:高中化学 来源:湖南师大附中2011-2012学年高一下学期段考化学试题 题型:013
|
下列反应中,不能说明CH3COOH的酸性比碳酸的酸性强的是 | |
| [ ] | |
A. |
HCl+CH3COONa |
B. |
CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O |
C. |
2CH3COOH+Na2CO3 |
D. |
2CH3COOH+CaCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com